FDA
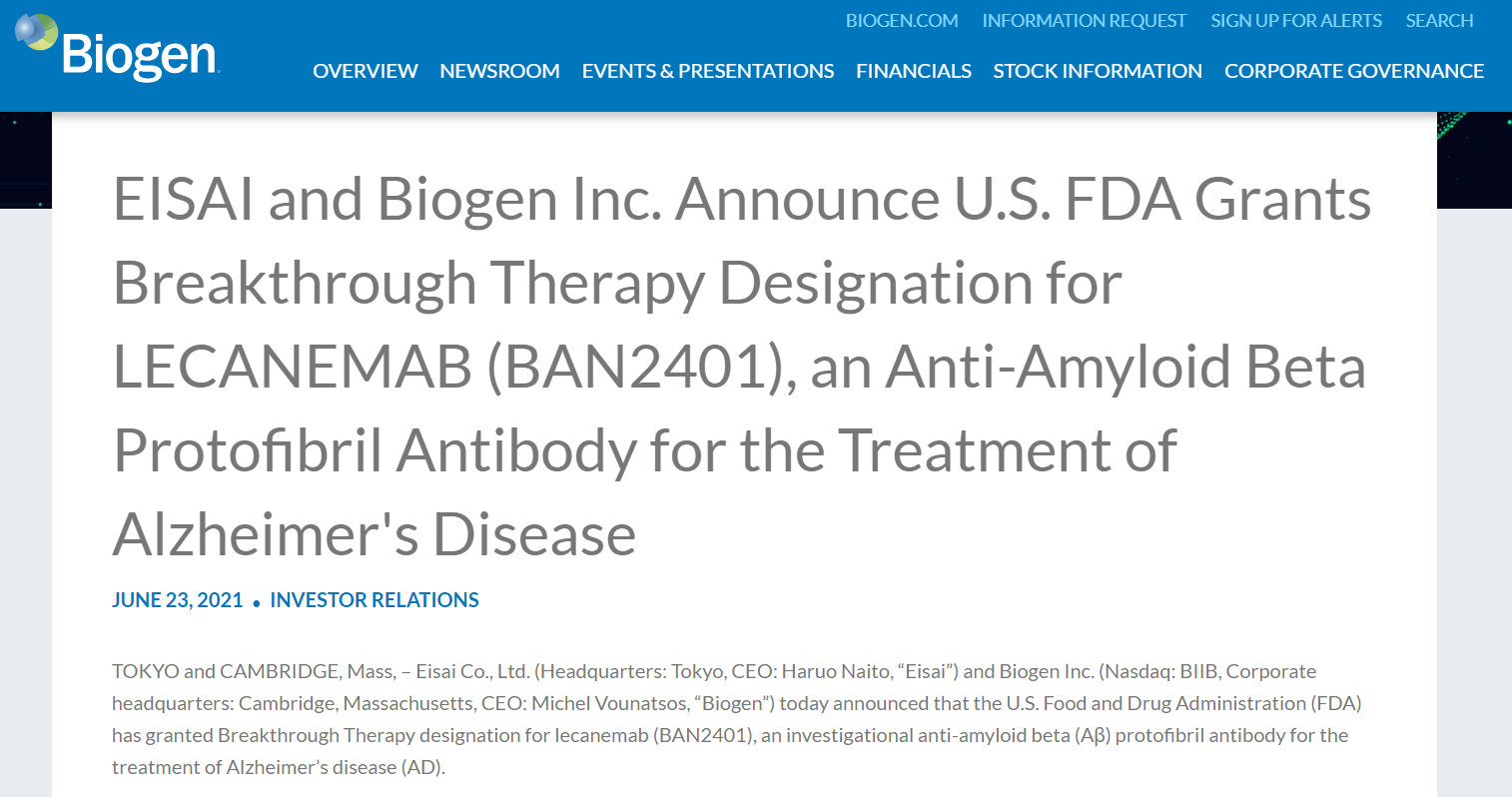
Biogen的BAN2401获FDA突破性治疗认定
6月23日,Eisai Co., Ltd.和Biogen Inc.合作开发的BAN2401(lecanemab)获FDA突破性治疗认定,用于治疗阿尔兹海默症(AD)。
👇 点击查看:
NMPA
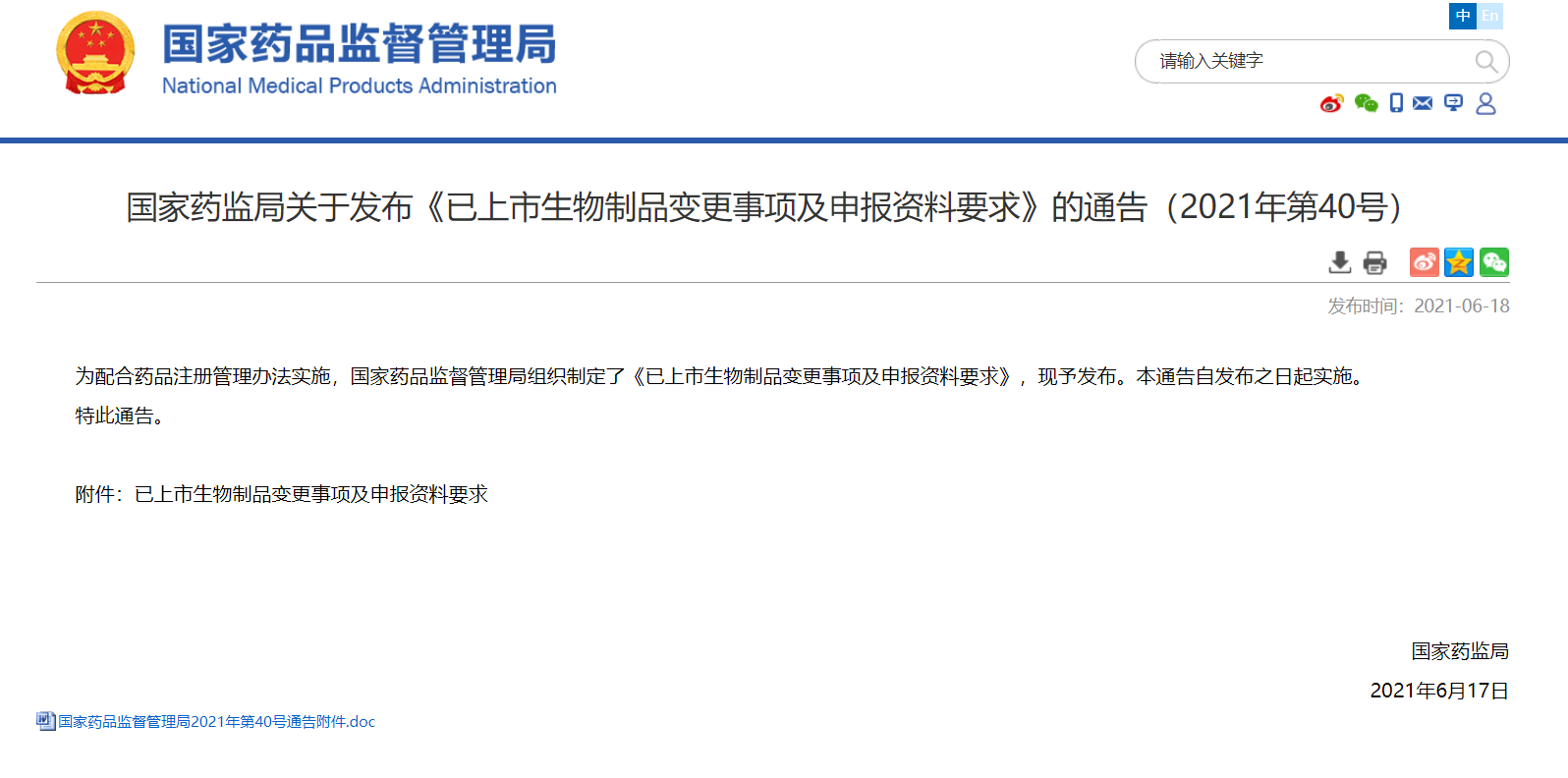
NMPA正式发布《已上市生物制品变更事项及申报资料要求》
6月18日,为配合药品注册管理办法实施,国家药品监督管理局正式发布了《已上市生物制品变更事项及申报资料要求》且自发布之日起实施。
👇 点击查看:
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20210618125831195.html
CDE正式发布《2020年度药品审评报告》
6月21日,CDE正式发布《2020年度药品审评报告》。其中,药审中心审评通过批准中药IND申请28件,NDA 4件;审评通过批准化药IND申请907件,较2019年增长51.42%,NDA 115件,较2019年增长30.68%,ANDA 918件,较2019年增长15.33%;审评通过批准生物制品IND申请500件,较2019年增长60.26%, NDA 89件,较2019年增长20.27%。

👇 点击查看:
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=cb377a202489c901
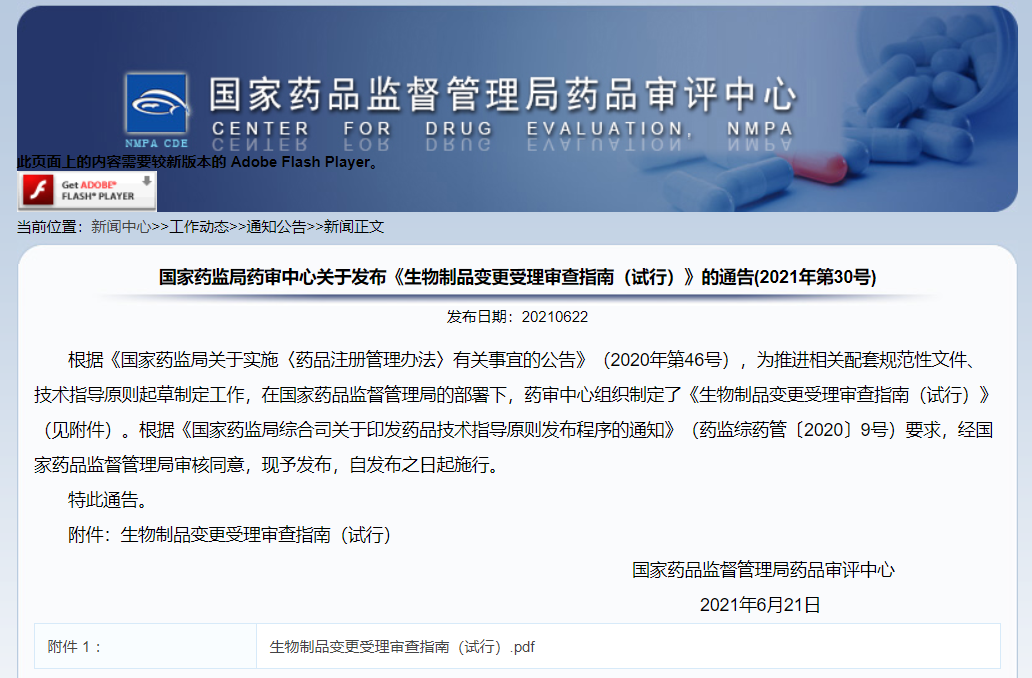
CDE正式发布《生物制品变更受理审查指南(试行)》
6月22日,根据《国家药监局关于实施〈药品注册管理办法〉有关事宜的公告》(2020年第46号),为推进相关配套规范性文件、技术指导原则起草制定工作,在国家药品监督管理局的部署下,药审中心发布了《生物制品变更受理审查指南(试行)》。该指南自发布之日起施行。
👇 点击查看:
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=d0ff7585b5400c40
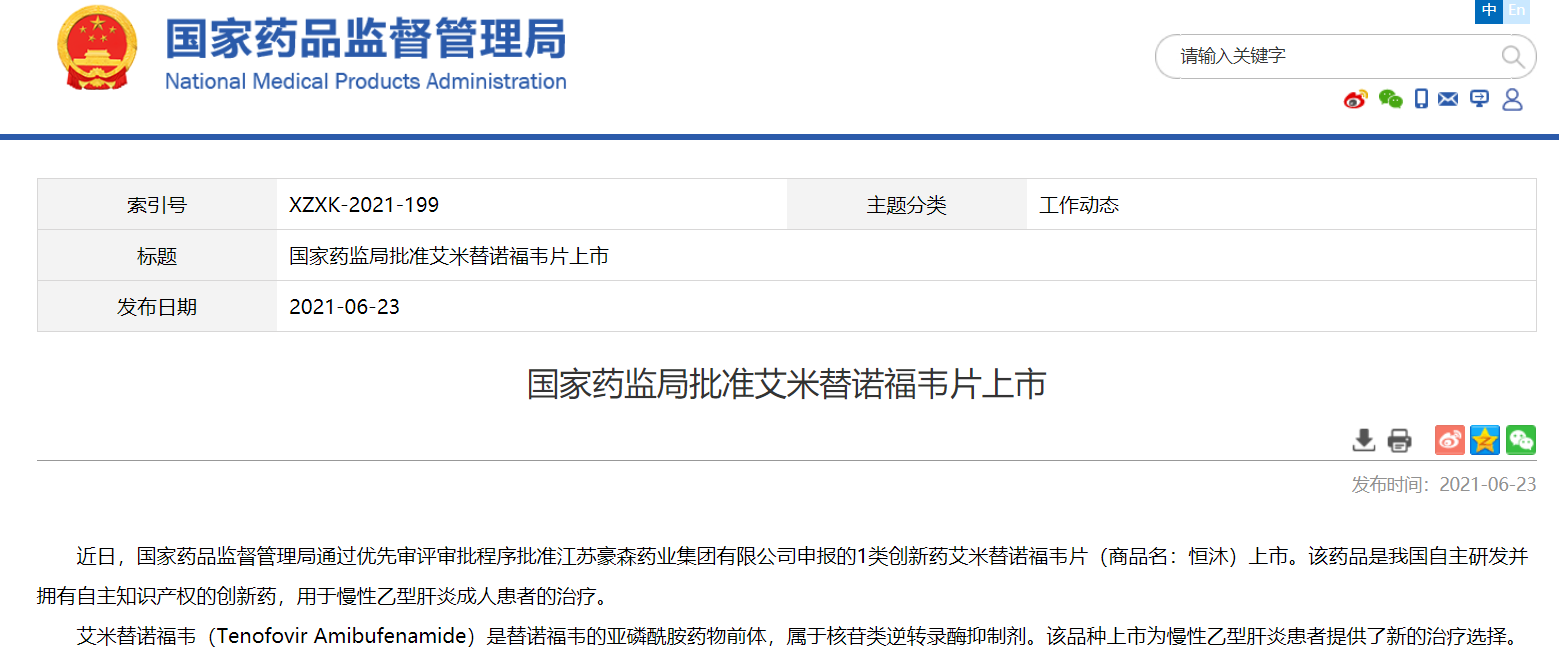
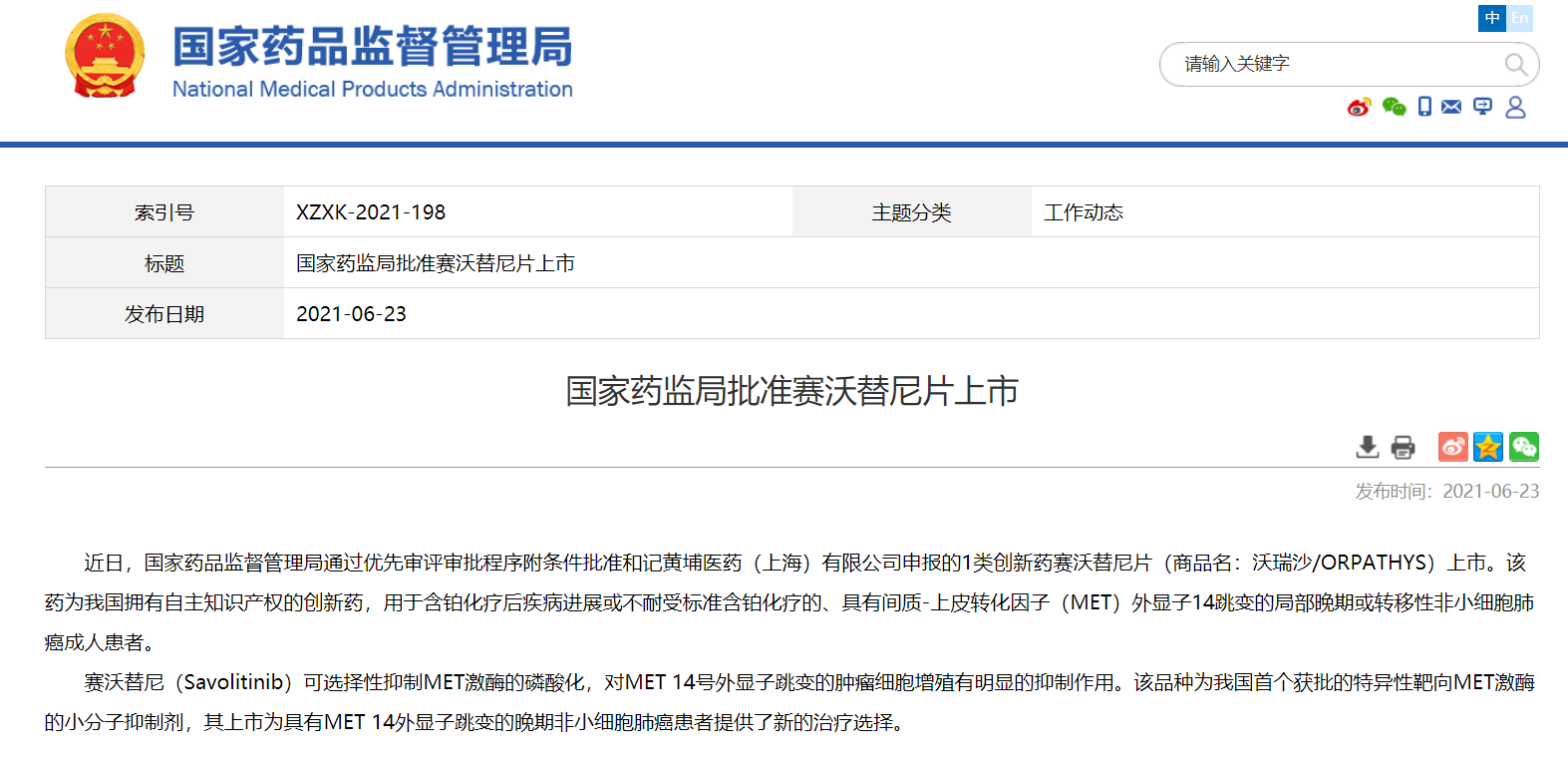
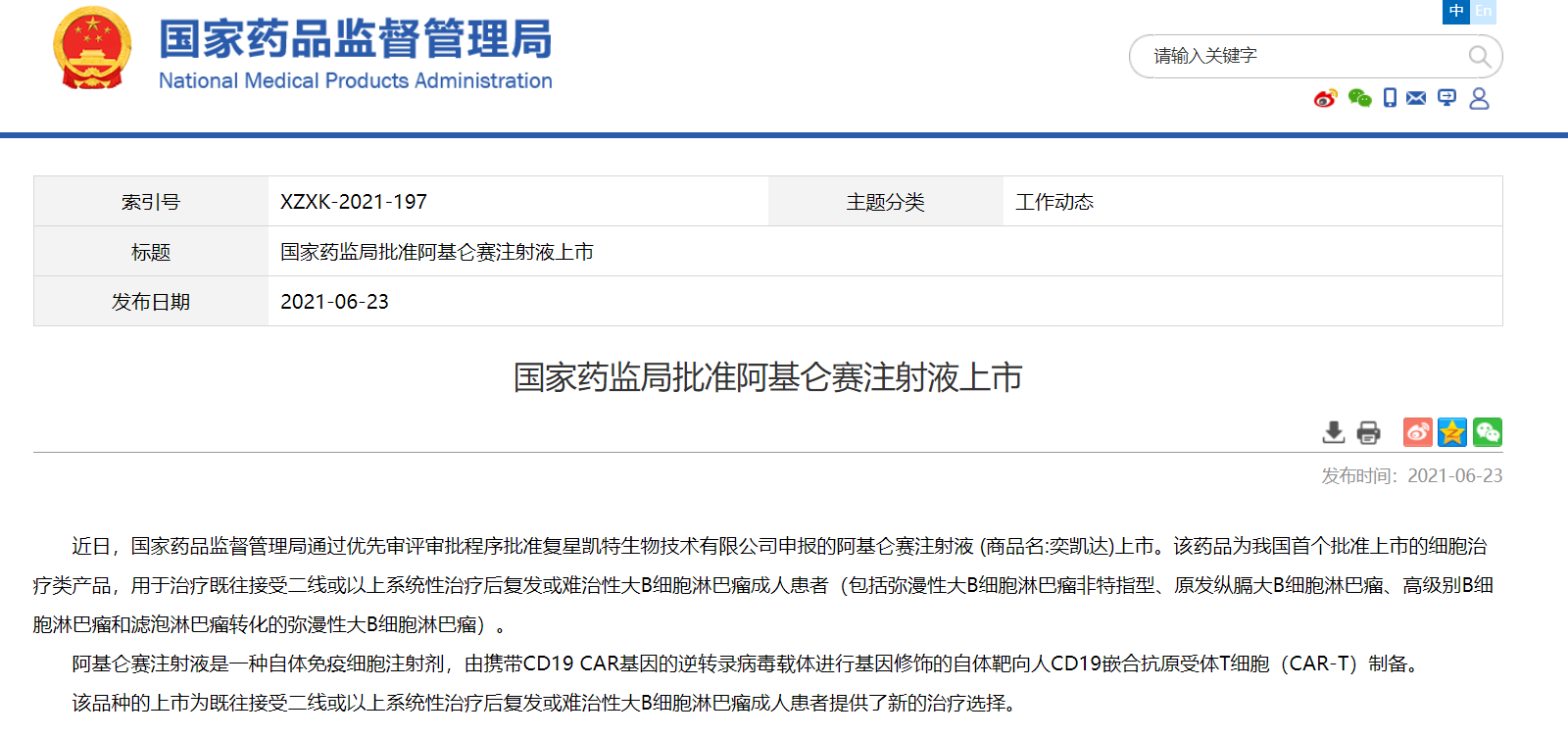
NMPA通过优先审评审批程序批准三款药物上市
近日,国家药品监督管理局通过优先审评审批程序批准三款药物上市:
1. 江苏豪森药业集团有限公司的艾米替诺福韦片(商品名:恒沐),用于慢性乙型肝炎成人患者的治疗;
2. 和记黄埔医药(上海)有限公司的赛沃替尼片(商品名:沃瑞沙/ORPATHYS),用于治疗含铂化疗后疾病进展或不耐受标准含铂化疗的、具有间质-上皮转化因子(MET)外显子14跳变的局部晚期或转移性非小细胞肺癌成人患者;
3. 复星凯特生物技术有限公司的阿基仑赛注射液 (商品名:奕凯达),用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者(包括弥漫性大B细胞淋巴瘤非特指型、原发纵膈大B细胞淋巴瘤、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的弥漫性大B细胞淋巴瘤)。
👇 点击查看:
https://www.nmpa.gov.cn/yaowen/ypjgyw/20210623094401176.html
https://www.nmpa.gov.cn/yaowen/ypjgyw/20210623094324131.html
https://www.nmpa.gov.cn/yaowen/ypjgyw/20210623094232187.html
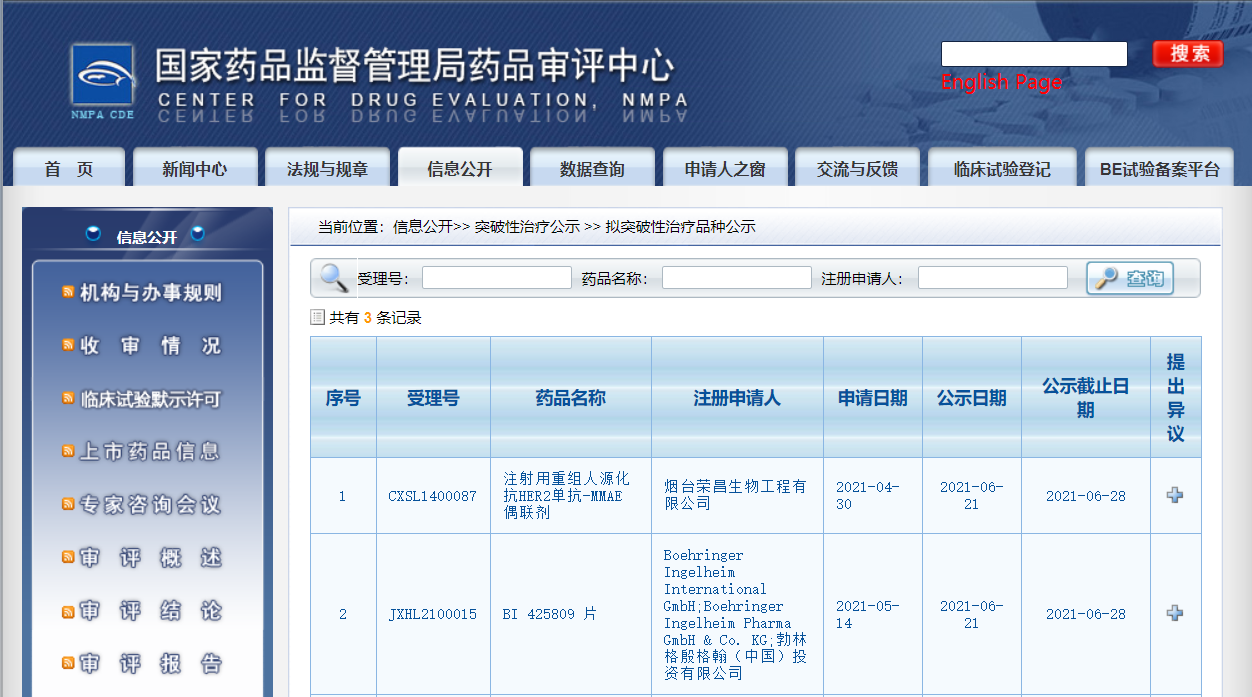
两款药物纳入拟突破性治疗品种
近日,CDE信息公示,两款药物纳入拟突破性治疗品种:
1. 勃林格殷格翰(中国)投资有限公司的BI 425809 片,拟用于治疗精神分裂症成人患者的认知障碍;
2. 烟台荣昌生物工程有限公司的注射用重组人源化抗HER2单抗-MMAE偶联剂,拟用于治疗既往接受过曲妥珠单抗和紫杉类药物治疗的HER2阳性存在肝转移的晚期乳腺癌患者。
👇 点击查看:
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20#


