FDA
FDA发布双特异性抗体研究指南终稿
5月24日,FDA发布了关于双特异性抗体研究指导原则终稿。该指导原则针对双特异性抗体的独特性,重点对质量、非临床以及临床研究方面进行了系统讨论,强调了基于科学性的开发,并为双抗研发提供了相应指导建议。相对于其他疗法,双特异性抗体有其潜在的优势,它们可以通过一种药物靶向多种由于疾病发生变化的分子。关于双特异性抗体的评价将会有更多的指导原则。

https://www.fda.gov/regulatory-information/search-fda-guidance-documents/bispecific-antibody-development-programs-guidance-industry
Apellis Pharmaceuticals的EMPAVELI™获FDA批准上市
5月14日,Apellis Pharmaceuticals, Inc.的EmpaveliTM(pegcetacoplan)获FDA批准上市,用于成人患者阵发性睡眠性血红蛋白尿症(PNH)的治疗。EmpaveliTM是首个获得FDA批准的C3靶向治疗该疾病的药物。该药物曾获得FDA孤儿药认定、快速通道以及优先审评认定。

https://www.fda.gov/drugs/drug-safety-and-availability/fda-approves-new-treatment-adults-serious-rare-blood-disease
百济神州BRUKINSA®补充新药申请获FDA优先审评认定
5月19日,百济神州Brukinsa® (zanubrutinib)补充新药申请(sNDA)获FDA受理并授予优先审评认定,用于治疗边缘区淋巴瘤(MZL)的成人患者(先前至少接受过一种抗CD20类药物治疗)。
https://ir.beigene.com/news-releases/news-release-details/beigene-announces-us-fda-acceptance-and-priority-review?loc=us
Takeda的MARIBAVIR获FDA优先审评认定
5月21日,Takeda Pharmaceutical Company Limited的Maribavir获FDA优先审评认定,用于治疗实体器官移植(SOT)或造血干细胞移植(HCT)受试者伴有的难治性(对当前标准的CMV治疗产生或不产生耐药性)巨细胞病毒(CMV)感染。

https://www.takeda.com/newsroom/newsreleases/2021/us-food--drug-administration-grants-priority-review-of-maribavir-for-the-treatment-of-post-transplant-recipients-with-cytomegalovirus-infection-in-those-resistant-andor-refractory-to-prior-anti-cmv-treatment/
Verastem的VS-6766与DEFACTINIB联用获FDA突破性治疗认定
5月24日,Verastem, Inc. 的VS-6766与Defactinib联用获FDA突破性治疗认定,用于治疗复发性低级别浆液性卵巢癌(LGSOC)患者(与KRAS状态无关),这些患者先前已经接受过一种或多种治疗(包括铂类化疗)。

https://investor.verastem.com/news-releases/news-release-details/verastem-oncology-receives-breakthrough-therapy-designation-vs
GlaxoSmithKline的SOTROVIMAB获FDA紧急使用授权
5月26日,GlaxoSmithKline plc的Sotrovimab获FDA紧急使用授权(EUA),用于SARS-CoV-2病毒直接检测结果阳性的成人和儿童患者(12岁及以上,体重不低于40 kg)轻到中度COVID-19的治疗,同时也适用于有发展为重度COVID-19(包括住院和死亡)风险的人群。
https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-additional-monoclonal-antibody-treatment-covid-19?utm_medium=email&utm_source=govdelivery
NMPA
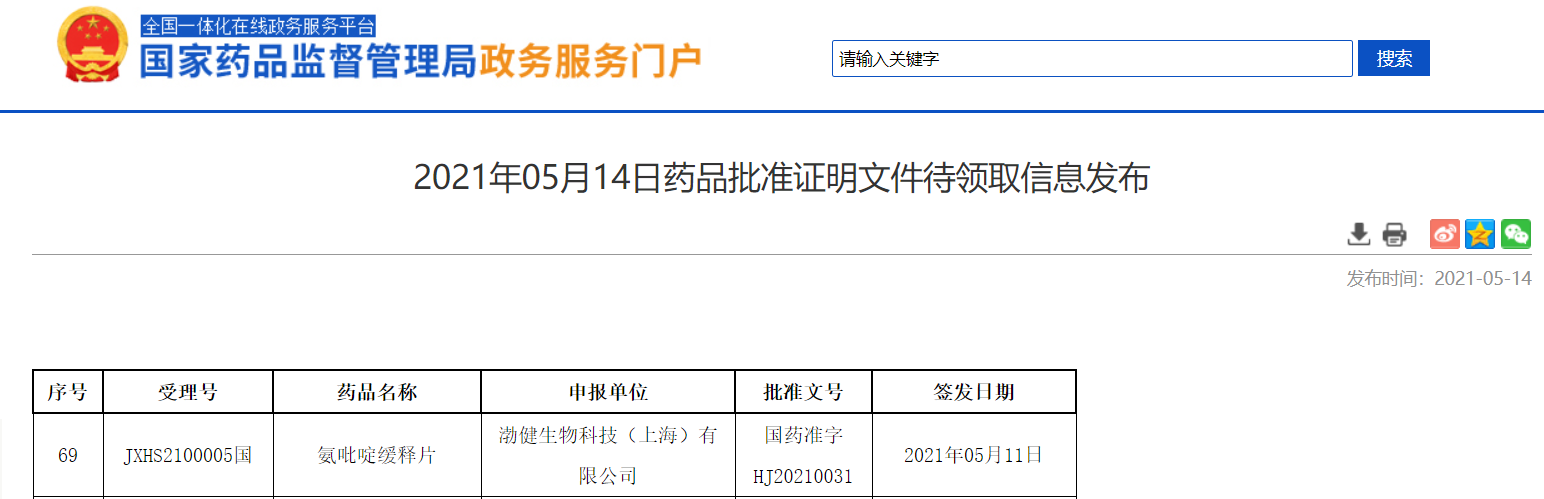
渤健生物氨吡啶缓释片获NMPA批准上市
5月14日,NMPA信息公示,渤健生物科技(上海)有限公司的氨吡啶缓释片获NMPA批准上市,用于改善多发性硬化(MS)成人患者的步行能力。氨吡啶缓释片是国内首个获批用于该适应症的药物。
https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20210514104413133.html
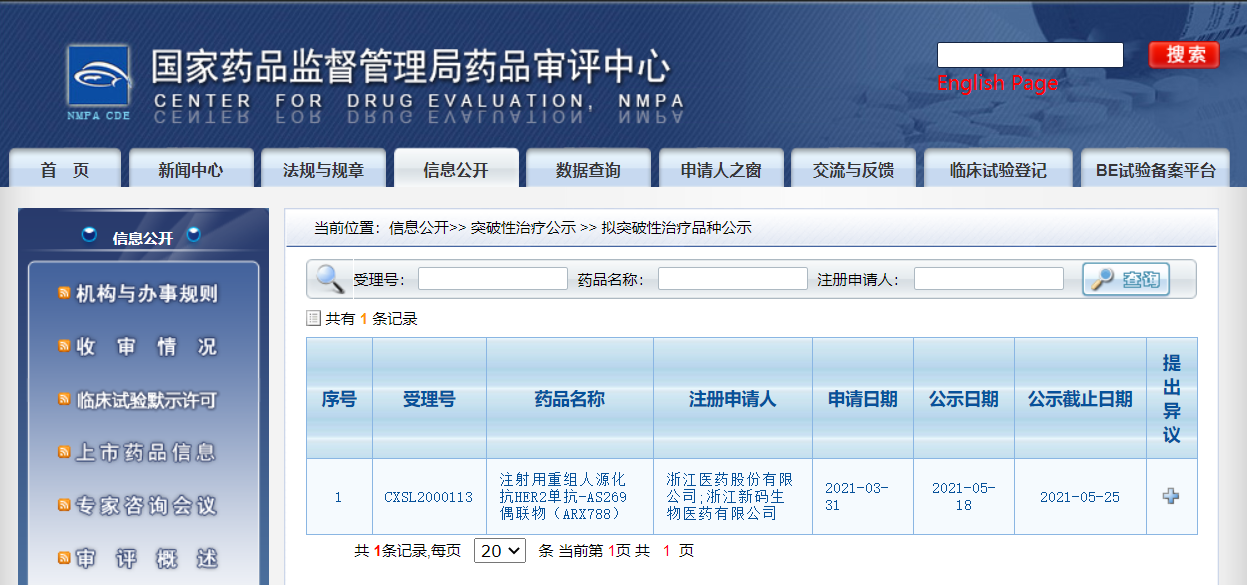
浙江医药抗HER2单抗-AS269偶联物(ARX788)纳入拟突破性治疗品种
5月18日,CDE信息公示,浙江医药股份有限公司的重组人源化抗HER2单抗-AS269偶联物(ARX788)纳入拟优突破性治疗品种,拟用于HER2阳性晚期乳腺癌的二线治疗。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20#
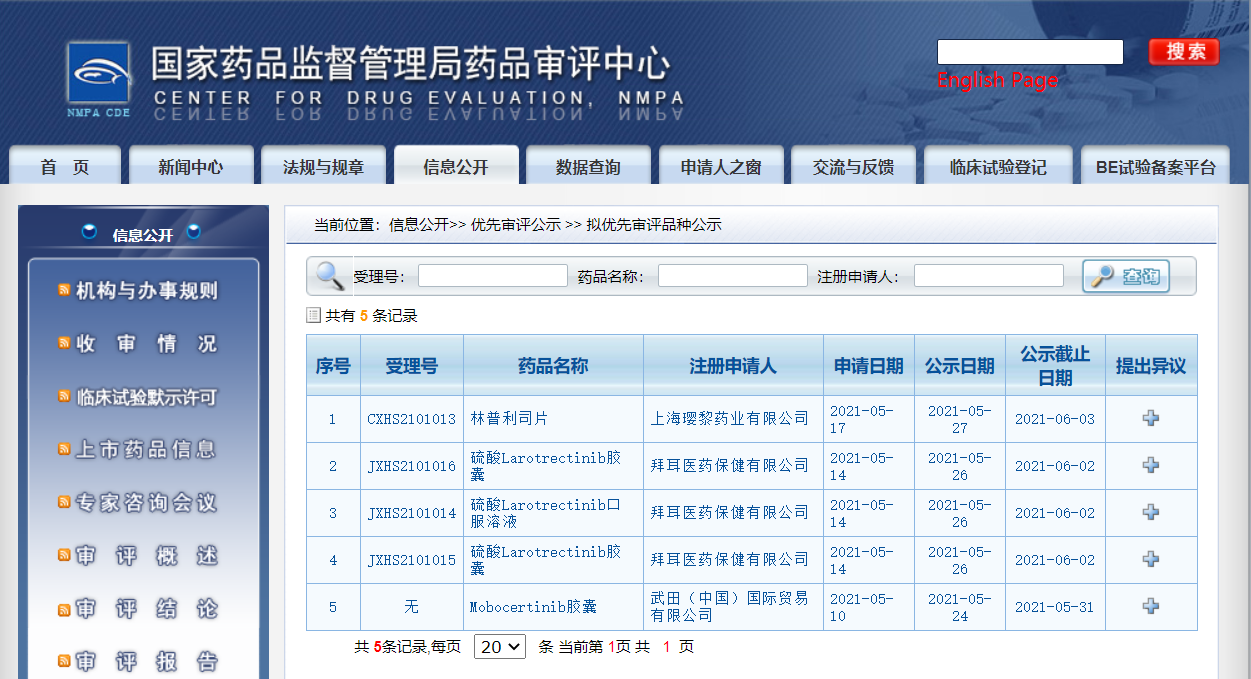
三款药物纳入拟优先审评品种
近日,CDE信息公示,三款药物纳入拟优先审评品种:1. 武田(中国)国际贸易有限公司的Mobocertinib胶囊,拟用于治疗既往接受过化疗且携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者;
2. 拜耳医药保健有限公司的硫酸Larotrectinib胶囊及口服溶液,拟用于治疗携带神经营养酪氨酸受体激酶(NTRK)融合基因的实体瘤成人和儿童患者和患有局部晚期、转移性疾病或手术切除可能导致严重并发症的患者,以及无满意治疗方案选择的患者;
3. 上海璎黎药业有限公司的林普利司片,拟用于治疗既往接受过二线或二线以上全身系统治疗的复发或难治滤泡性淋巴瘤患者。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20


