[1] 奥来恩专家解读:FDA加快创新药研发与审评的通道-2020年CDER批准的新药分析.2021-02-05. https://mp.weixin.qq.com/s/uJRZz12QwAmvdWEaz6Oq5g.
为鼓励研发具有明显临床优势的药物,国家药品监督管理局(NMPA),在2020年《药品注册管理办法》中规定了药品加快上市注册程序的四个通道。其中“突破性治疗药物程序”是通过早期临床数据发掘优势产品、集中多方资源重点研发、缩短优势产品研发周期,从而让患者早日获得更好治疗的快速通道之一。在奥来恩药政法规的「专家解读」之新药研发与审评的加速通道系列中,我们向大家介绍过美国FDA关于突破性治疗认定(BTD)的相关法规与申请程序。为了帮助读者深入了解,本期「专家解读」栏目我们就中美两国药品监管部门对于突破性治疗药物的审评进行简要比较。
为鼓励研发具有明显临床优势的药物,国家药品监督管理局( NMPA ) ,在 2020 年《药品注册管理办法》中规定了药品加快上市注册程序的四个通道。 其中 “ 突破性治疗药物程序 ” 是通过早期临床数据发掘优势产品、集中多方资源重点研发、缩短优势产品研发周期,从而让患者早日获得更好治疗的快速通道之一。在奥来恩药政法规的「 专家解读」 之新药研发与审评的加速通道系列中,我们向大家介绍过美国 FDA 关于突破性治疗认定( BTD )的相关法规与申请程序。为了帮助读者深入了解, 本期 「专家解读」栏目 我们就中美两国药品监管部门对于突破性治疗药物的审评进行简要比较。
NMPA
FDA
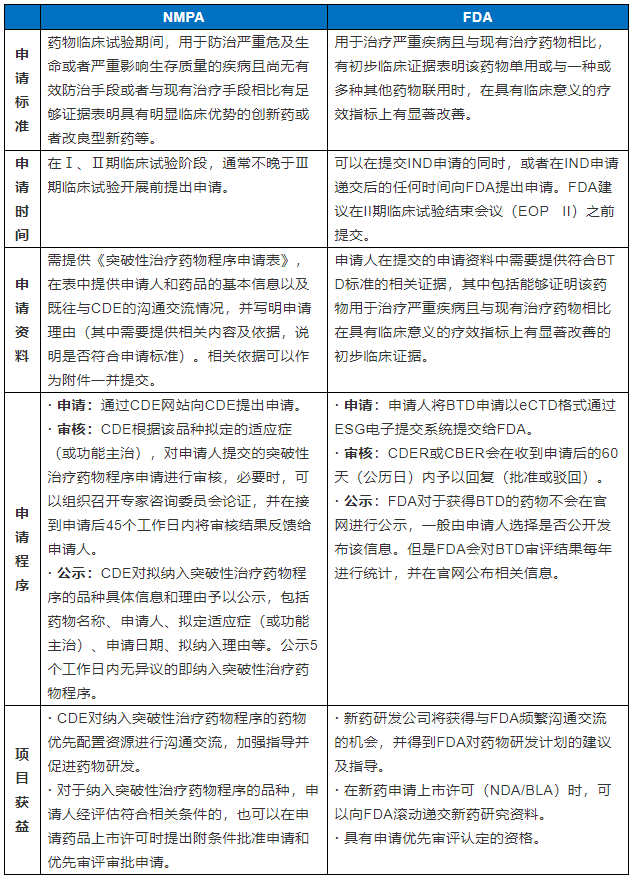
申请标准
药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等。
用于治疗严重疾病且与现有治疗药物相比,有初步临床证据表明该药物单用或与一种或多种其他药物联用时,在具有临床意义的疗效指标上有显著改善。
申请时间
在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前提出申请。
可以在提交IND申请的同时,或者在IND申请递交后的任何时间向FDA提出申请。FDA建议在II期临床试验结束会议(EOP II)之前提交。
申请资料
需提供《突破性治疗药物程序申请表》,在表中提供申请人和药品的基本信息以及既往与CDE的沟通交流情况,并写明申请理由(其中需要提供相关内容及依据,说明是否符合申请标准)。相关依据可以作为附件一并提交。
申请人在提交的申请资料中需要提供符合BTD标准的相关证据,其中包括能够证明该药物用于治疗严重疾病且与现有治疗药物相比在具有临床意义的疗效指标上有显著改善的初步临床证据。
申请程序
· 申请: 通过CDE网站向CDE提出申请。
· 审核: CDE根据该品种拟定的适应症(或功能主治),对申请人提交的突破性治疗药物程序申请进行审核,必要时,可以组织召开专家咨询委员会论证,并在接到申请后45个工作日内将审核结果反馈给申请人。
· 公示: CDE对拟纳入突破性治疗药物程序的品种具体信息和理由予以公示,包括药物名称、申请人、拟定适应症(或功能主治)、申请日期、拟纳入理由等。公示5个工作日内无异议的即纳入突破性治疗药物程序。
· 申请 :申请人将BTD申请以eCTD格式通过ESG电子提交系统提交给FDA。
· 审核 :CDER或CBER会在收到申请后的60天(公历日)内予以回复(批准或驳回)。
· 公示 :FDA对于获得BTD的药物不会在官网进行公示,一般由申请人选择是否公开发布该信息。但是FDA会对BTD审评结果每年进行统计,并在官网公布相关信息。
项目获益
· CDE对纳入突破性治疗药物程序的药物优先配置资源进行沟通交流,加强指导并促进药物研发。
· 对于纳入突破性治疗药物程序的品种,申请人经评估符合相关条件的,也可以在申请药品上市许可时提出附条件批准申请和优先审评审批申请。
· 新药研发公司将获得与FDA频繁沟通交流的机会,并得到FDA对药物研发计划的建议及指导。
· 在新药申请上市许可(NDA/BLA)时,可以向FDA滚动递交新药研究资料。
· 具有申请优先审评认定的资格。
NMPA:自2020年7月7日发布《突破性治疗药物审评工作程序(试行)》细则起,截至2021年5月14日,共收到224 项申请,其中48项新药申请被纳入突破性治疗品种,申请成功率为21.4%。在这些成功纳入突破性治疗品种的申请中,化学药有31项,生物药有17项。
FDA:从2020年1月1日起截至2021年3月31日的最新数据显示,CDER与CBER共收到199项申请, 其中80项申请获得突破性治疗认定,申请成功率为40%。这些成功获得BTD的申请中包括了已经获批上市的24 种化学药和22 种生物药(含新增适应症申请)。
奥来恩作为专业化的新药法规咨询与注册团队,凭借多年的FDA、NMPA及其他主要国际市场的药政法规咨询与注册经验,包括多个准备与申请FDA突破性治疗认定的成功经验,为您提供BTD差距分析、申请策略规划、资料准备以及与FDA的有效沟通交流,助力您的新药获得突破性治疗认定并早日成功获批,造福患者。
为鼓励研发具有明显临床优势的药物,国家药品监督管理局( NMPA ) ,在 2020 年《药品注册管理办法》中规定了药品加快上市注册程序的四个通道。 其中 “ 突破性治疗药物程序 ” 是通过早期临床数据发掘优势产品、集中多方资源重点研发、缩短优势产品研发周期,从而让患者早日获得更好治疗的快速通道之一。在奥来恩药政法规的「 专家解读」 之新药研发与审评的加速通道系列中,我们向大家介绍过美国 FDA 关于突破性治疗认定( BTD )的相关法规与申请程序。为了帮助读者深入了解, 本期 「专家解读」栏目 我们就中美两国药品监管部门对于突破性治疗药物的审评进行简要比较。
NMPA
FDA
申请标准
药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等。
用于治疗严重疾病且与现有治疗药物相比,有初步临床证据表明该药物单用或与一种或多种其他药物联用时,在具有临床意义的疗效指标上有显著改善。
申请时间
在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前提出申请。
可以在提交IND申请的同时,或者在IND申请递交后的任何时间向FDA提出申请。FDA建议在II期临床试验结束会议(EOP II)之前提交。
申请资料
需提供《突破性治疗药物程序申请表》,在表中提供申请人和药品的基本信息以及既往与CDE的沟通交流情况,并写明申请理由(其中需要提供相关内容及依据,说明是否符合申请标准)。相关依据可以作为附件一并提交。
申请人在提交的申请资料中需要提供符合BTD标准的相关证据,其中包括能够证明该药物用于治疗严重疾病且与现有治疗药物相比在具有临床意义的疗效指标上有显著改善的初步临床证据。
申请程序
· 申请: 通过CDE网站向CDE提出申请。
· 审核: CDE根据该品种拟定的适应症(或功能主治),对申请人提交的突破性治疗药物程序申请进行审核,必要时,可以组织召开专家咨询委员会论证,并在接到申请后45个工作日内将审核结果反馈给申请人。
· 公示: CDE对拟纳入突破性治疗药物程序的品种具体信息和理由予以公示,包括药物名称、申请人、拟定适应症(或功能主治)、申请日期、拟纳入理由等。公示5个工作日内无异议的即纳入突破性治疗药物程序。
· 申请 :申请人将BTD申请以eCTD格式通过ESG电子提交系统提交给FDA。
· 审核 :CDER或CBER会在收到申请后的60天(公历日)内予以回复(批准或驳回)。
· 公示 :FDA对于获得BTD的药物不会在官网进行公示,一般由申请人选择是否公开发布该信息。但是FDA会对BTD审评结果每年进行统计,并在官网公布相关信息。
项目获益
· CDE对纳入突破性治疗药物程序的药物优先配置资源进行沟通交流,加强指导并促进药物研发。
· 对于纳入突破性治疗药物程序的品种,申请人经评估符合相关条件的,也可以在申请药品上市许可时提出附条件批准申请和优先审评审批申请。
· 新药研发公司将获得与FDA频繁沟通交流的机会,并得到FDA对药物研发计划的建议及指导。
· 在新药申请上市许可(NDA/BLA)时,可以向FDA滚动递交新药研究资料。
· 具有申请优先审评认定的资格。
NMPA:自2020年7月7日发布《突破性治疗药物审评工作程序(试行)》细则起,截至2021年5月14日,共收到224 项申请,其中48项新药申请被纳入突破性治疗品种,申请成功率为21.4%。在这些成功纳入突破性治疗品种的申请中,化学药有31项,生物药有17项。
FDA:从2020年1月1日起截至2021年3月31日的最新数据显示,CDER与CBER共收到199项申请, 其中80项申请获得突破性治疗认定,申请成功率为40%。这些成功获得BTD的申请中包括了已经获批上市的24 种化学药和22 种生物药(含新增适应症申请)。
奥来恩作为专业化的新药法规咨询与注册团队,凭借多年的FDA、NMPA及其他主要国际市场的药政法规咨询与注册经验,包括多个准备与申请FDA突破性治疗认定的成功经验,为您提供BTD差距分析、申请策略规划、资料准备以及与FDA的有效沟通交流,助力您的新药获得突破性治疗认定并早日成功获批,造福患者。
为鼓励研发具有明显临床优势的药物,国家药品监督管理局( NMPA ) ,在 2020 年《药品注册管理办法》中规定了药品加快上市注册程序的四个通道。 其中 “ 突破性治疗药物程序 ” 是通过早期临床数据发掘优势产品、集中多方资源重点研发、缩短优势产品研发周期,从而让患者早日获得更好治疗的快速通道之一。在奥来恩药政法规的「 专家解读」 之新药研发与审评的加速通道系列中,我们向大家介绍过美国 FDA 关于突破性治疗认定( BTD )的相关法规与申请程序。为了帮助读者深入了解, 本期 「专家解读」栏目 我们就中美两国药品监管部门对于突破性治疗药物的审评进行简要比较。
NMPA
FDA
申请标准
药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等。
用于治疗严重疾病且与现有治疗药物相比,有初步临床证据表明该药物单用或与一种或多种其他药物联用时,在具有临床意义的疗效指标上有显著改善。
申请时间
在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前提出申请。
可以在提交IND申请的同时,或者在IND申请递交后的任何时间向FDA提出申请。FDA建议在II期临床试验结束会议(EOP II)之前提交。
申请资料
需提供《突破性治疗药物程序申请表》,在表中提供申请人和药品的基本信息以及既往与CDE的沟通交流情况,并写明申请理由(其中需要提供相关内容及依据,说明是否符合申请标准)。相关依据可以作为附件一并提交。
申请人在提交的申请资料中需要提供符合BTD标准的相关证据,其中包括能够证明该药物用于治疗严重疾病且与现有治疗药物相比在具有临床意义的疗效指标上有显著改善的初步临床证据。
申请程序
· 申请: 通过CDE网站向CDE提出申请。
· 审核: CDE根据该品种拟定的适应症(或功能主治),对申请人提交的突破性治疗药物程序申请进行审核,必要时,可以组织召开专家咨询委员会论证,并在接到申请后45个工作日内将审核结果反馈给申请人。
· 公示: CDE对拟纳入突破性治疗药物程序的品种具体信息和理由予以公示,包括药物名称、申请人、拟定适应症(或功能主治)、申请日期、拟纳入理由等。公示5个工作日内无异议的即纳入突破性治疗药物程序。
· 申请 :申请人将BTD申请以eCTD格式通过ESG电子提交系统提交给FDA。
· 审核 :CDER或CBER会在收到申请后的60天(公历日)内予以回复(批准或驳回)。
· 公示 :FDA对于获得BTD的药物不会在官网进行公示,一般由申请人选择是否公开发布该信息。但是FDA会对BTD审评结果每年进行统计,并在官网公布相关信息。
项目获益
· CDE对纳入突破性治疗药物程序的药物优先配置资源进行沟通交流,加强指导并促进药物研发。
· 对于纳入突破性治疗药物程序的品种,申请人经评估符合相关条件的,也可以在申请药品上市许可时提出附条件批准申请和优先审评审批申请。
· 新药研发公司将获得与FDA频繁沟通交流的机会,并得到FDA对药物研发计划的建议及指导。
· 在新药申请上市许可(NDA/BLA)时,可以向FDA滚动递交新药研究资料。
· 具有申请优先审评认定的资格。
NMPA:自2020年7月7日发布《突破性治疗药物审评工作程序(试行)》细则起,截至2021年5月14日,共收到224 项申请,其中48项新药申请被纳入突破性治疗品种,申请成功率为21.4%。在这些成功纳入突破性治疗品种的申请中,化学药有31项,生物药有17项。
FDA:从2020年1月1日起截至2021年3月31日的最新数据显示,CDER与CBER共收到199项申请, 其中80项申请获得突破性治疗认定,申请成功率为40%。这些成功获得BTD的申请中包括了已经获批上市的24 种化学药和22 种生物药(含新增适应症申请)。
奥来恩作为专业化的新药法规咨询与注册团队,凭借多年的FDA、NMPA及其他主要国际市场的药政法规咨询与注册经验,包括多个准备与申请FDA突破性治疗认定的成功经验,为您提供BTD差距分析、申请策略规划、资料准备以及与FDA的有效沟通交流,助力您的新药获得突破性治疗认定并早日成功获批,造福患者。
为鼓励研发具有明显临床优势的药物,国家药品监督管理局(NMPA ),在2020 年《药品注册管理办法》中规定了药品加快上市注册程序的四个通道。其中“ 突破性治疗药物程序” 是通过早期临床数据发掘优势产品、集中多方资源重点研发、缩短优势产品研发周期,从而让患者早日获得更好治疗的快速通道之一。在奥来恩药政法规的「专家解读」之新药研发与审评的加速通道系列中,我们向大家介绍过美国FDA 关于突破性治疗认定(BTD )的相关法规与申请程序。为了帮助读者深入了解,本期「专家解读」栏目我们就中美两国药品监管部门对于突破性治疗药物的审评进行简要比较。
图片
01
突破性治疗药物申请与审评的中美比较
图片
NMPA
FDA
申请标准
药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等。
用于治疗严重疾病且与现有治疗药物相比,有初步临床证据表明该药物单用或与一种或多种其他药物联用时,在具有临床意义的疗效指标上有显著改善。
申请时间
在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前提出申请。
可以在提交IND 申请的同时,或者在IND 申请递交后的任何时间向FDA 提出申请。FDA 建议在II 期临床试验结束会议(EOP II )之前提交。
申请资料
需提供《突破性治疗药物程序申请表》,在表中提供申请人和药品的基本信息以及既往与CDE 的沟通交流情况,并写明申请理由(其中需要提供相关内容及依据,说明是否符合申请标准)。相关依据可以作为附件一并提交。
申请人在提交的申请资料中需要提供符合BTD 标准的相关证据,其中包括能够证明该药物用于治疗严重疾病且与现有治疗药物相比在具有临床意义的疗效指标上有显著改善的初步临床证据。
申请程序
· 申请:通过CDE 网站向CDE 提出申请。
· 审核:CDE 根据该品种拟定的适应症(或功能主治),对申请人提交的突破性治疗药物程序申请进行审核,必要时,可以组织召开专家咨询委员会论证,并在接到申请后45 个工作日内将审核结果反馈给申请人。
· 公示:CDE 对拟纳入突破性治疗药物程序的品种具体信息和理由予以公示,包括药物名称、申请人、拟定适应症(或功能主治)、申请日期、拟纳入理由等。公示5 个工作日内无异议的即纳入突破性治疗药物程序。
· 申请:申请人将BTD 申请以eCTD 格式通过ESG 电子提交系统提交给FDA 。
· 审核:CDER 或CBER 会在收到申请后的60 天(公历日)内予以回复(批准或驳回)。
· 公示:FDA 对于获得BTD 的药物不会在官网进行公示,一般由申请人选择是否公开发布该信息。但是FDA 会对BTD 审评结果每年进行统计,并在官网公布相关信息。
项目获益
· CDE 对纳入突破性治疗药物程序的药物优先配置资源进行沟通交流,加强指导并促进药物研发。
· 对于纳入突破性治疗药物程序的品种,申请人经评估符合相关条件的,也可以在申请药品上市许可时提出附条件批准申请和优先审评审批申请。
· 新药研发公司将获得与FDA 频繁沟通交流的机会,并得到FDA 对药物研发计划的建议及指导。
· 在新药申请上市许可(NDA/BLA )时,可以向FDA 滚动递交新药研究资料。
· 具有申请优先审评认定的资格。
图片
02
NMPA 与FDA 批准的突破性治疗药物认定申请
图片
NMPA :自2020 年7 月7 日发布《突破性治疗药物审评工作程序(试行)》细则起,截至2021 年5 月14 日,共收到224 项申请,其中48 项新药申请被纳入突破性治疗品种,申请成功率为21.4% 。在这些成功纳入突破性治疗品种的申请中,化学药有31 项,生物药有17 项。
FDA :从2020 年1 月1 日起截至2021 年3 月31 日的最新数据显示,CDER 与CBER 共收到199 项申请, 其中80 项申请获得突破性治疗认定,申请成功率为40% 。这些成功获得BTD 的申请中包括了已经获批上市的24 种化学药和22 种生物药(含新增适应症申请)。
03
奥来恩如何帮助您成功获得BTD ?
图片
奥来恩作为专业化的新药法规咨询与注册团队,凭借多年的FDA 、NMPA 及其他主要国际市场的药政法规咨询与注册经验,包括多个准备与申请FDA 突破性治疗认定的成功经验,为您提供BTD 差距分析、申请策略规划、资料准备以及与FDA 的有效沟通交流,助力您的新药获得突破性治疗认定并早日成功获批,造福患者。
信息来源:
[1] 奥来恩专家解读:FDA 加快创新药研发与审评的通道-2020 年CDER 批准的新药分析.2021-02-05. https://mp.weixin.qq.com/s/uJRZz12QwAmvdWEaz6Oq5g.
[2] 《突破性治疗药物审评工作程序(试行)》,2020-07-07 ,国家药品监督管理局。
[3] 《药品注册管理办法》,2020-01-22 ,国家药品监督管理局。
[4] FDA Final Guidance for Industry:Expedited Programs for Serious Conditions-Drugs and Biologics. 05/30/2014.
[5] FDA Website: Breakthrough Therapy.01/04/2018.https://www.fda.gov/patients/fast-track-breakthrough-therapy-accelerated-approval-priority-review/breakthrough-therapy.
[6] 奥来恩专家解读:FDA 突破性治疗认定- 新药研发与审评的加速通道系列之一. 2021-02-20.https://mp.weixin.qq.com/s/9VKk5U_cthiZXuoHjKbw7A.
为鼓励研发具有明显临床优势的药物,国家药品监督管理局(NMPA ),在2020 年《药品注册管理办法》中规定了药品加快上市注册程序的四个通道。其中“ 突破性治疗药物程序” 是通过早期临床数据发掘优势产品、集中多方资源重点研发、缩短优势产品研发周期,从而让患者早日获得更好治疗的快速通道之一。在奥来恩药政法规的「专家解读」之新药研发与审评的加速通道系列中,我们向大家介绍过美国FDA 关于突破性治疗认定(BTD )的相关法规与申请程序。为了帮助读者深入了解,本期「专家解读」栏目我们就中美两国药品监管部门对于突破性治疗药物的审评进行简要比较。
图片
01
突破性治疗药物申请与审评的中美比较
图片
NMPA
FDA
申请标准
药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等。
用于治疗严重疾病且与现有治疗药物相比,有初步临床证据表明该药物单用或与一种或多种其他药物联用时,在具有临床意义的疗效指标上有显著改善。
申请时间
在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前提出申请。
可以在提交IND 申请的同时,或者在IND 申请递交后的任何时间向FDA 提出申请。FDA 建议在II 期临床试验结束会议(EOP II )之前提交。
申请资料
需提供《突破性治疗药物程序申请表》,在表中提供申请人和药品的基本信息以及既往与CDE 的沟通交流情况,并写明申请理由(其中需要提供相关内容及依据,说明是否符合申请标准)。相关依据可以作为附件一并提交。
申请人在提交的申请资料中需要提供符合BTD 标准的相关证据,其中包括能够证明该药物用于治疗严重疾病且与现有治疗药物相比在具有临床意义的疗效指标上有显著改善的初步临床证据。
申请程序
· 申请:通过CDE 网站向CDE 提出申请。
· 审核:CDE 根据该品种拟定的适应症(或功能主治),对申请人提交的突破性治疗药物程序申请进行审核,必要时,可以组织召开专家咨询委员会论证,并在接到申请后45 个工作日内将审核结果反馈给申请人。
· 公示:CDE 对拟纳入突破性治疗药物程序的品种具体信息和理由予以公示,包括药物名称、申请人、拟定适应症(或功能主治)、申请日期、拟纳入理由等。公示5 个工作日内无异议的即纳入突破性治疗药物程序。
· 申请:申请人将BTD 申请以eCTD 格式通过ESG 电子提交系统提交给FDA 。
· 审核:CDER 或CBER 会在收到申请后的60 天(公历日)内予以回复(批准或驳回)。
· 公示:FDA 对于获得BTD 的药物不会在官网进行公示,一般由申请人选择是否公开发布该信息。但是FDA 会对BTD 审评结果每年进行统计,并在官网公布相关信息。
项目获益
· CDE 对纳入突破性治疗药物程序的药物优先配置资源进行沟通交流,加强指导并促进药物研发。
· 对于纳入突破性治疗药物程序的品种,申请人经评估符合相关条件的,也可以在申请药品上市许可时提出附条件批准申请和优先审评审批申请。
· 新药研发公司将获得与FDA 频繁沟通交流的机会,并得到FDA 对药物研发计划的建议及指导。
· 在新药申请上市许可(NDA/BLA )时,可以向FDA 滚动递交新药研究资料。
· 具有申请优先审评认定的资格。
图片
02
NMPA 与FDA 批准的突破性治疗药物认定申请
图片
NMPA :自2020 年7 月7 日发布《突破性治疗药物审评工作程序(试行)》细则起,截至2021 年5 月14 日,共收到224 项申请,其中48 项新药申请被纳入突破性治疗品种,申请成功率为21.4% 。在这些成功纳入突破性治疗品种的申请中,化学药有31 项,生物药有17 项。
FDA :从2020 年1 月1 日起截至2021 年3 月31 日的最新数据显示,CDER 与CBER 共收到199 项申请, 其中80 项申请获得突破性治疗认定,申请成功率为40% 。这些成功获得BTD 的申请中包括了已经获批上市的24 种化学药和22 种生物药(含新增适应症申请)。
03
奥来恩如何帮助您成功获得BTD ?
图片
奥来恩作为专业化的新药法规咨询与注册团队,凭借多年的FDA 、NMPA 及其他主要国际市场的药政法规咨询与注册经验,包括多个准备与申请FDA 突破性治疗认定的成功经验,为您提供BTD 差距分析、申请策略规划、资料准备以及与FDA 的有效沟通交流,助力您的新药获得突破性治疗认定并早日成功获批,造福患者。
信息来源:
[1] 奥来恩专家解读:FDA 加快创新药研发与审评的通道-2020 年CDER 批准的新药分析.2021-02-05. https://mp.weixin.qq.com/s/uJRZz12QwAmvdWEaz6Oq5g.
[2] 《突破性治疗药物审评工作程序(试行)》,2020-07-07 ,国家药品监督管理局。
[3] 《药品注册管理办法》,2020-01-22 ,国家药品监督管理局。
[4] FDA Final Guidance for Industry:Expedited Programs for Serious Conditions-Drugs and Biologics. 05/30/2014.
[5] FDA Website: Breakthrough Therapy.01/04/2018.https://www.fda.gov/patients/fast-track-breakthrough-therapy-accelerated-approval-priority-review/breakthrough-therapy.
[6] 奥来恩专家解读:FDA 突破性治疗认定- 新药研发与审评的加速通道系列之一. 2021-02-20.https://mp.weixin.qq.com/s/9VKk5U_cthiZXuoHjKbw7A.