FDA
辉瑞LORBRENA® (LORLATINIB)补充新药申请获FDA优先审评认定
12月28日,辉瑞LORBRENA® (LORLATINIB)补充新药申请(supplemental New Drug Application, sNDA)获FDA优先审评认定,新适应症为间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)阳性转移性非小细胞肺癌(nonsmall cell lung cancer, NSCLC)。

https://www.pfizer.com/news/press-release/press-release-detail/lorbrenar-lorlatinib-snda-previously-untreated-alk-positive
NMPA
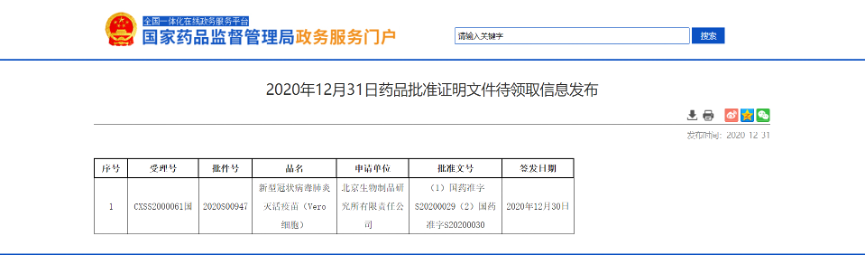
中国新冠病毒肺炎灭活疫苗获批上市
12月31日,国药集团新型冠状病毒肺炎灭活疫苗(Vero 细胞)获得NMPA批准附条件上市。该疫苗是首家获批的国产新冠病毒灭活疫苗,适用于预防由新型冠状病毒感染引起的疾病(COVID-19)。
https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20201231102922128.html
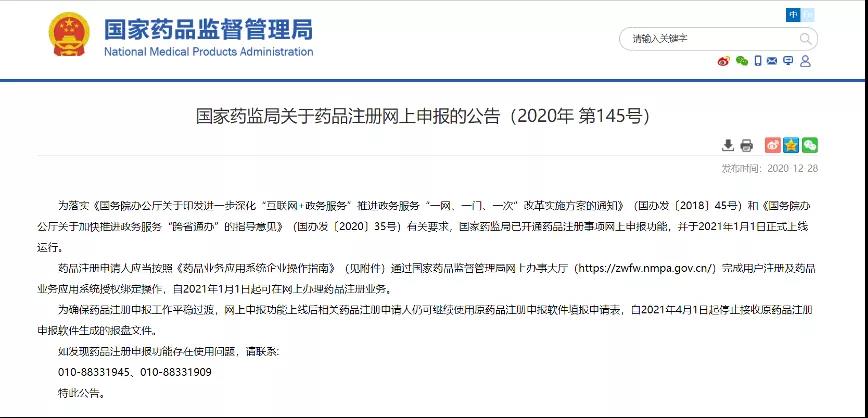
药品注册网上申报将于2021年1月1日正式上线运行
为落实《国务院办公厅关于印发进一步深化“互联网+政务服务”推进政务服务“一网、一门、一次”改革实施方案的通知》和《国务院办公厅关于加快推进政务服务“跨省通办”的指导意见》有关要求,国家药监局已开通药品注册事项网上申报功能,并于2021年1月1日正式上线运行。为确保药品注册申报工作平稳过渡,网上申报功能上线后相关药品注册申请人仍可继续使用原药品注册申报软件填报申请表,自2021年4月1日起停止接收原药品注册申报软件生成的报盘文件。
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20201228212507162.html
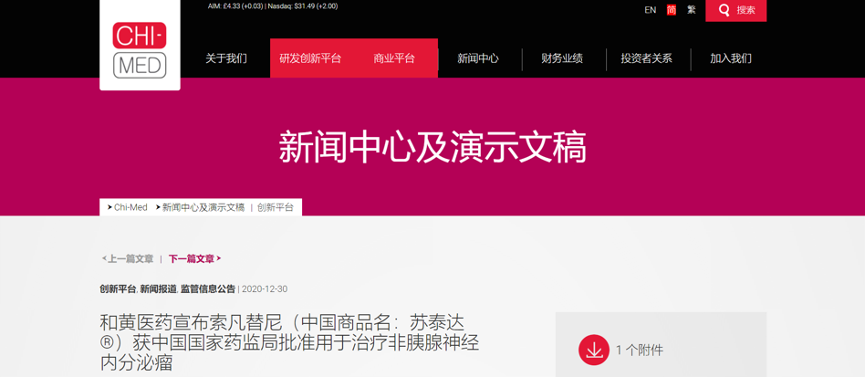
和黄医药索凡替尼获NMPA批准上市
12月30日,和黄医药宣布索凡替尼获NMPA批准用于治疗非胰腺神经内分泌瘤。该药物是和黄医药首个独立完成开发的自主研发肿瘤药物,也是和黄医药于中国获批的第二款肿瘤药物。
https://www.chi-med.com/sc/chi-med-announces-the-nmpa-approval-of-surufatinib-sulanda-in-china-for-epnet/
信达生物贝伐珠单抗注射液新适应症获批
12月25日,NMPA信息公示,信达生物制药(苏州)有限公司自主开发的重组抗VEGF人源化单克隆抗体药物达攸同®(贝伐珠单抗)正式获得NMPA批准,用于治疗成人复发性胶质母细胞瘤(GBM,最常见的原发性脑部恶性肿瘤),这也是达攸同®获批的第三个适应症。

https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20201225091230197.html
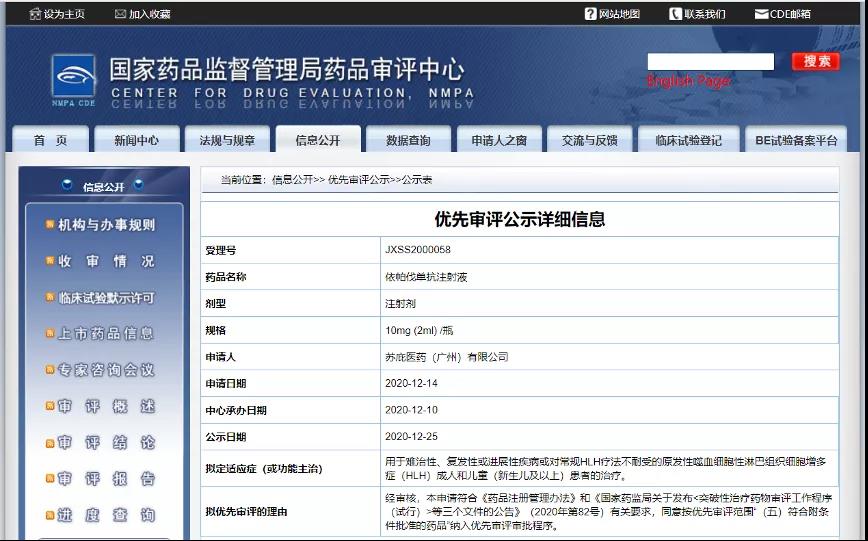
苏庇医药依帕伐单抗注射液纳入拟优先审评品种
12月25日,CDE信息公示,苏庇医药(广州)有限公司依帕伐单抗注射液纳入拟优先审评品种,拟适应症为成人和儿童(新生儿及以上)难治性、复发性或进展性疾病或对常规HLH疗法不耐受的原发性噬血细胞性淋巴组织细胞增多症(HLH)。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=21#


