FDA
首个治疗晚期前列腺癌口服激素药物获FDA批准
12月18日,Myovant Sciences公司Orgovyx (relugolix)获FDA批准用于前列腺癌晚期的成年患者。Orgovyx此前曾获FDA优先审评认定,是首个也是唯一一个获FDA批准用于治疗晚期前列腺癌的口服促性腺激素释放激素(GnRH)受体拮抗剂。Orgovyx通过抑制垂体分泌黄体生成素和卵泡刺激素降低睾丸素水平(睾丸素会刺激前列腺癌细胞增殖),从而达到治疗目的。
首个非小细胞肺癌术后辅助治疗药物获FDA批准
12月18日,AstraZeneca公司Tagrisso (osimertinib)获FDA批准成为首个早期非小细胞肺癌(表皮生长因子受体突变型,EGFRm)切除手术(具有治愈意图)的术后辅助治疗药物。Tagrisso在2018年获FDA批准成为治疗携带EGFR外显子19缺失或外显子21 L858R突变的转移性非小细胞肺癌的一线药物。此外,Tagrisso“治疗表皮生长因子受体突变阳性的非小细胞肺癌”这一适应症获FDA孤儿药认定。

https://www.fda.gov/news-events/press-announcements/fda-approves-first-adjuvant-therapy-most-common-type-lung-cancer?utm_medium=email&utm_source=govdelivery
Moderna COVID-19疫苗获FDA紧急使用授权
12月18日,Moderna, Inc. 的COVID-19疫苗获FDA紧急使用授权(Emergency Use Authorization, EUA),用于预防18岁及以上人群中由严重急性呼吸综合征冠状病毒2号(SARS-CoV-2)引起的新型冠状病毒肺炎,这也是第二款获得FDA紧急使用授权的COVID-19疫苗。

https://www.fda.gov/news-events/press-announcements/fda-takes-additional-action-fight-against-covid-19-issuing-emergency-use-authorization-second-covid
Ebanga (Ansuvimab-zykl)获FDA批准用于治疗埃博拉病毒感染
12月21日,Ridgeback Biotherapeutics LP 的Ebanga (Ansuvimab-zykl)获FDA批准,用于治疗成人和儿童扎伊尔埃波拉病毒(Zaire ebolavirus)感染。Ebanga通过抑制病毒与细胞受体结合来阻止病毒进入细胞内以达到治疗目的。此外,Ebanga还获得了孤儿药和突破性疗法认定。
https://www.fda.gov/drugs/drug-safety-and-availability/fda-approves-treatment-ebola-virus?utm_medium=email&utm_source=govdelivery
NMPA
迪哲医药DZD9008片纳入拟突破性治疗品种
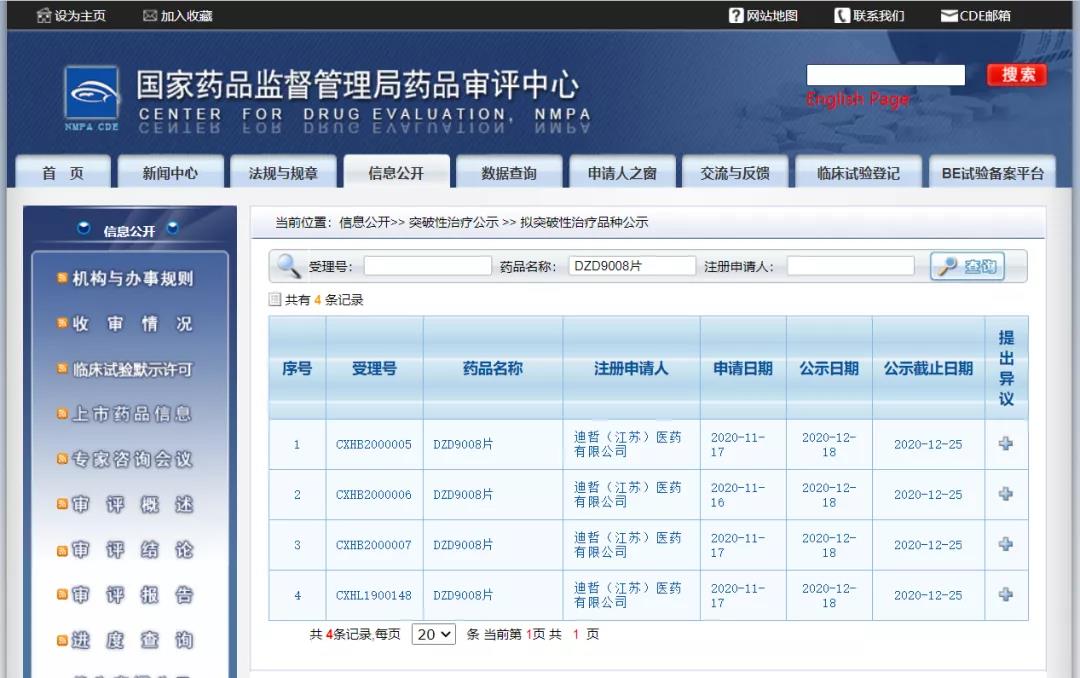
12月18日,CDE信息公示,迪哲(江苏)医药有限公司DZD9008片纳入拟突破性治疗药物,拟定适应症为既往至少接受过一次全身化疗的携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)。
http://www.cde.org.cn/news.do?method=changePage&pageName=service#
基石药业BLU-667胶囊纳入拟突破性治疗药物
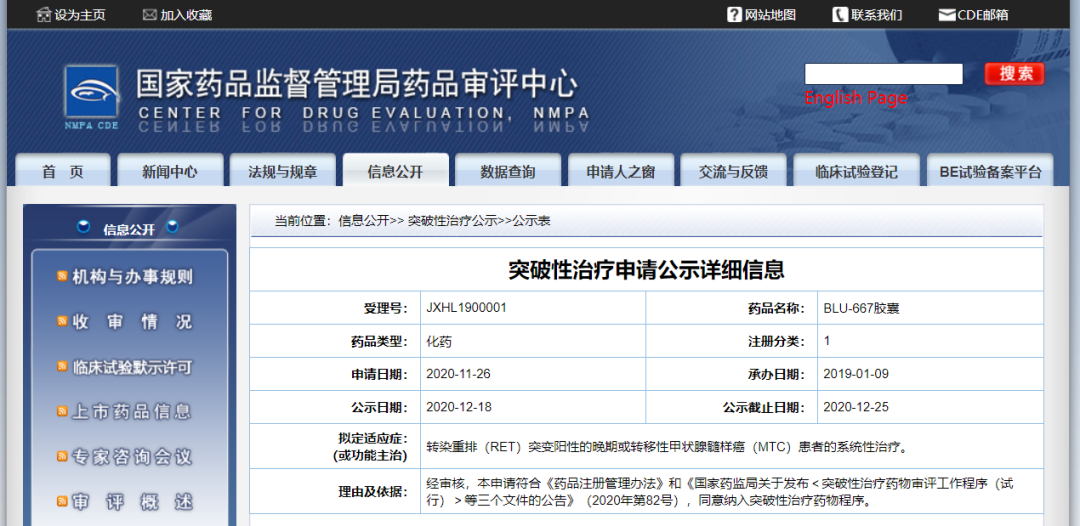
12月18日,CDE信息公示,基石药业(苏州)有限公司BLU-667胶囊纳入拟突破性治疗药物,拟定适应症为转染重排(RET)突变阳性的晚期或转移性甲状腺髓样癌(MTC)患者的系统性治疗。
http://www.cde.org.cn/news.do?method=changePage&pageName=service#
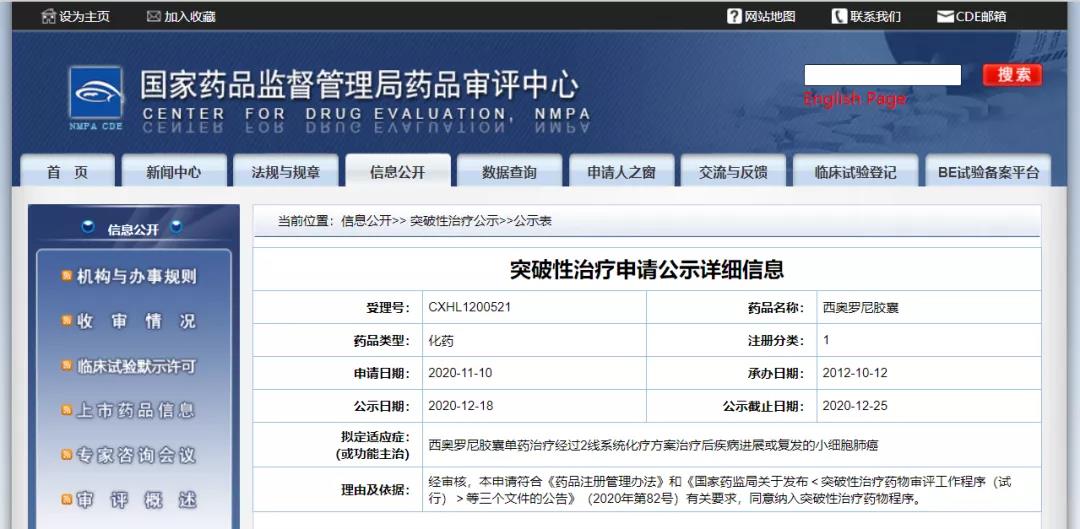
微芯生物西奥罗尼胶囊纳入拟突破性治疗药物
12月18日,CDE信息公示,深圳微芯生物科技有限责任公司西奥罗尼胶囊纳入拟突破性治疗药物,拟定适应症为经过二线系统化疗方案治疗后疾病进展或复发的小细胞肺癌。
http://www.cde.org.cn/news.do?method=changePage&pageName=service#
阿斯利康奥拉帕利片纳入拟优先审评品种
12月22日,CDE信息公示,阿斯利康投资(中国)有限公司奥拉帕利片纳入拟优先审评品种,拟定适应症为携带BRCA1/2突变(胚系和/或体细胞系)且在既往新型激素药物治疗后出现疾病进展的转移性去势抵抗性前列腺癌成人患者的单药治疗。

http://www.cde.org.cn/news.do?method=changePage&pageName=service#
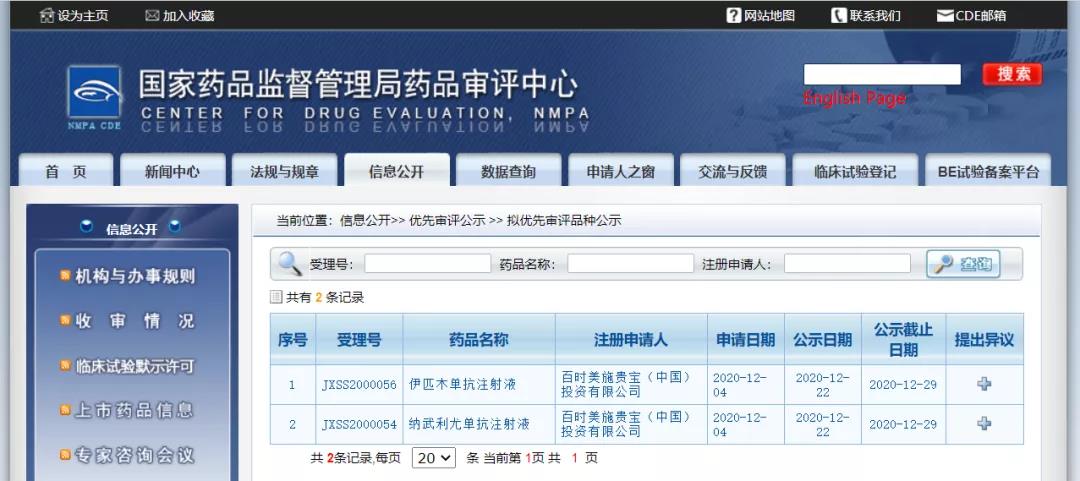
百时美施贵宝公司伊匹木单抗注射液和纳武利尤单抗注射液纳入拟优先审评品种
12月22日,CDE信息公示,百时美施贵宝(中国)投资有限公司伊匹木单抗注射液和纳武利尤单抗注射液纳入拟优先审评品种,拟定适应症为两者联合用于成人患者初治的不可切除的非上皮样型恶性胸膜间皮瘤。
http://www.cde.org.cn/news.do?method=changePage&pageName=service#
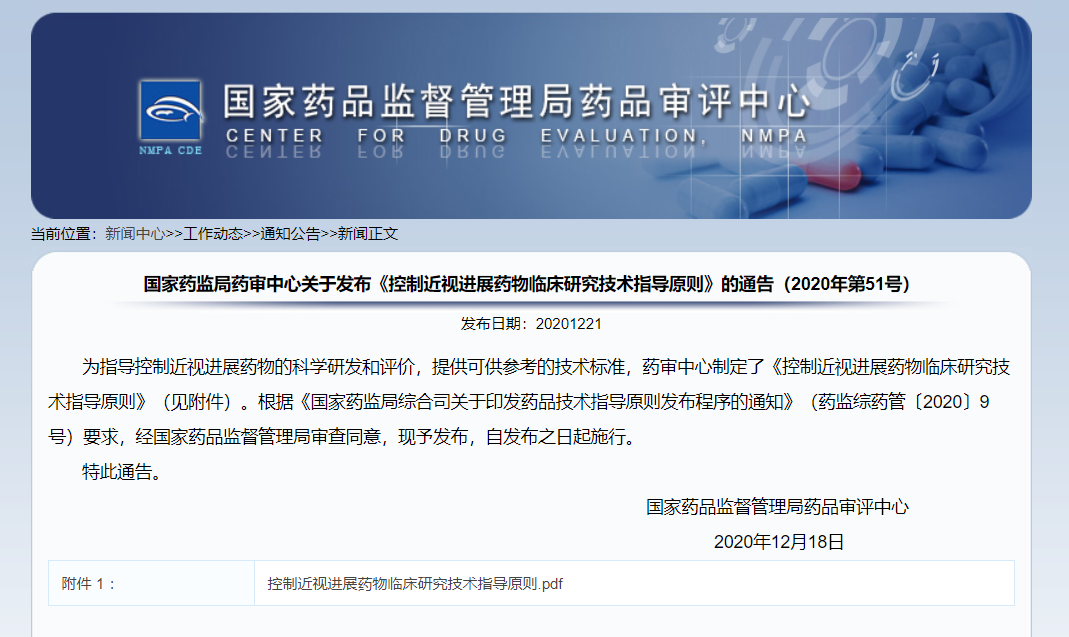
CDE正式发布《控制近视进展药物临床研究技术指导原则》
12月21日,为指导控制近视进展药物的科学研发和评价,提供可供参考的技术标准,药审中心发布了《控制近视进展药物临床研究技术指导原则》。
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=9ce2bc86689a894b


