FDA
FDA顾问委员会建议批准Pfizer-BioNTech COVID-19疫苗用于紧急使用
经过本周四(12月10日)的全天会议,由独立的科学专家、传染病医生以及统计学家等成员组成的FDA疫苗和相关生物制品顾问委员会以17票赞成、4票反对、1票弃权,建议对16岁及以上人群进行紧急使用授权(Emergency Use Authorization, EUA)。基于顾问委员会的建议,FDA可能最快于本周五批准Pfizer-BioNTech COVID-19疫苗用于紧急使用。FDA疫苗和相关生物制品顾问委员会将在12月17日公开会议上讨论Moderna 公司的COVID-19疫苗用于18岁及以上人群紧急使用授权(EUA)。(*根据FDA疫苗和相关生物制品委员会12月10日会议结果和FDA官网内容整理)

Saxenda®获FDA批准成为近10年来首个治疗青少年肥胖症的药物
12月4日 Novo Nordisk inc.的Saxenda®(liraglutide,利拉鲁肽)获FDA批准用于治疗12岁及以上青少年肥胖症,这些青少年体重超过60 kg且初始身体质量指数(BMI)对应于成人的30kg/m2或者更高。Saxenda®在2014年就已经被FDA批准用于成人(BMI≥30 kg/m2,或者BMI≥27 kg/m2,且至少伴有一种体重相关的并发症)的长期体重控制。该药物是一种胰高血糖素样肽-1(GLP-1)受体激动剂,在低能量饮食和增加运动的基础上起辅助作用。
Orladeyo™(berotralstat)获FDA批准成为首款预防HAE发作的口服非甾体药物
近日,BioCryst Pharmaceuticals正式宣布,美国FDA已批准Orladeyo™(berotralstat)上市,作为一款每日单次的口服药物,用于预防成人与12岁及以上儿科患者的遗传性血管水肿(HAE)发作。新闻稿指出,这是首款预防HAE发作的口服非甾体药物。
信息来源:
https://www.biocryst.com/orladeyo/
糖尿病药物(含西格列汀)说明书改变获FDA批准
12月4日,FDA批准糖尿病药物说明书改变,改变内容为:Januvia®(西格列汀片)、Janumet®(西格列汀二甲双胍片)、Janumet XR®(西格列汀缓释片)无法被证明能在12-17岁的2型糖尿病儿童患者身上起到控制血糖的作用。此次改变是基于三组双盲、安慰剂对照试验,最终试验结果表明药物组与安慰剂组血糖水平并无显著差异。
https://www.fda.gov/drugs/drug-safety-and-availability/new-studies-show-diabetes-drug-not-proven-improve-blood-sugar-control-pediatric-patients?utm_medium=email&utm_source=govdelivery
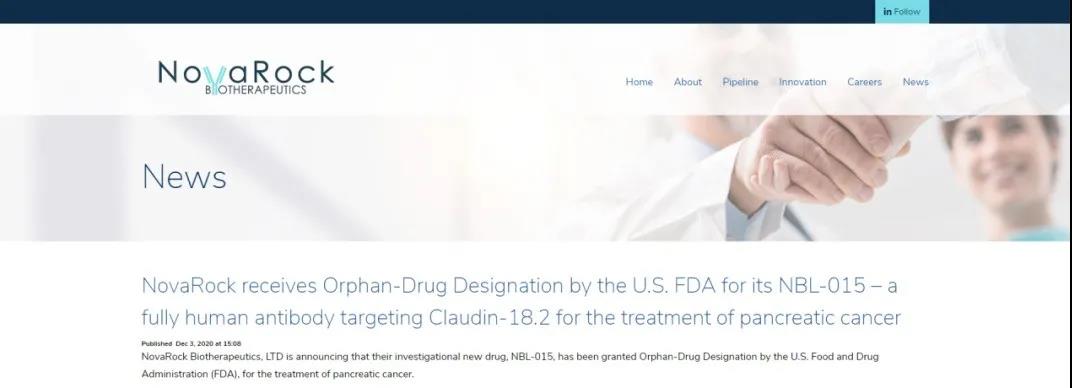
NBL-015获FDA治疗胰腺癌的孤儿药资格认定
近日,石药集团发布公告,集团附属公司美国NovaRock Biotherapeutics Limited自主研发的抗体药物NBL-015 (一种全人源抗Claudin-18.2的单克隆抗体) 获得美国FDA颁发针对治疗胰腺癌的孤儿药资格认定。
https://www.novarockbio.com/novarock-receives-orphan-drug-designation-by-the-u-s-fda-for-its-nbl-015-a-fully-human-antibody-targeting-claudin-18-2-for-the-treatment-of-pancreatic-cancer/
NMPA
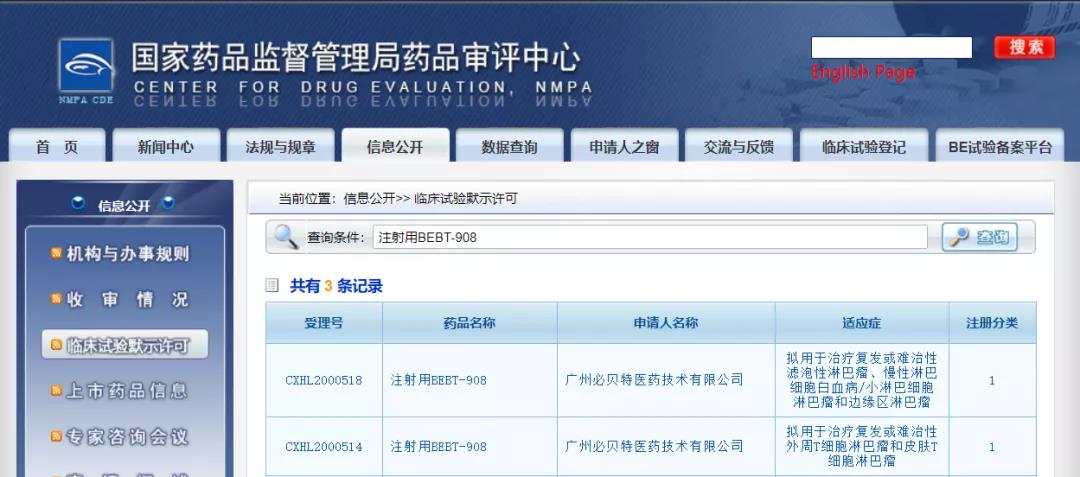
必贝特医药注射用BEBT-908获批临床
近日,CDE信息公示,广州必贝特医药技术有限公司的HDAC/PI3K双靶点抗癌一类新药——注射用BEBT-908获得两项临床试验默示许可,拟适应症为复发或难治性滤泡性淋巴瘤、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤和边缘区淋巴瘤,以及复发或难治性外周T细胞淋巴瘤和皮肤T细胞淋巴瘤。
http://www.cde.org.cn/news.do?method=changePage&pageName=service
艾伯维医药维奈克拉片获NMPA附条件批准
NMPA信息公示,艾伯维医药贸易(上海)有限公司维奈克拉片(venetoclax)获NMPA附条件批准,拟适应症为与阿扎胞苷联合治疗因合并症不适合接受强诱导化疗或患者年龄在75岁及以上的新诊断的成人急性髓系白血病(AML)。维奈克拉片是中国首个且目前唯一获批的B细胞淋巴瘤因子-2(BCL-2)抑制剂,标志着中国急性髓系白血病领域进入了靶向治疗时代。

https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20201207163143123.html
葛兰素史克注射用贝利尤单抗儿童适应症获批
NMPA信息公示,葛兰素史克(中国)投资有限公司注射用贝利尤单抗(belimumab)获批儿童适应症,拟用于在常规治疗基础上仍具有高疾病活动的活动性、自身抗体阳性的系统性红斑狼疮(SLE)的5 岁及以上患者。此前,该药品已获批成人SLE适应症。贝利尤单抗是我国目前首个且唯一一个覆盖儿童及成人SLE治疗的生物制剂。

https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20201207163143123.html
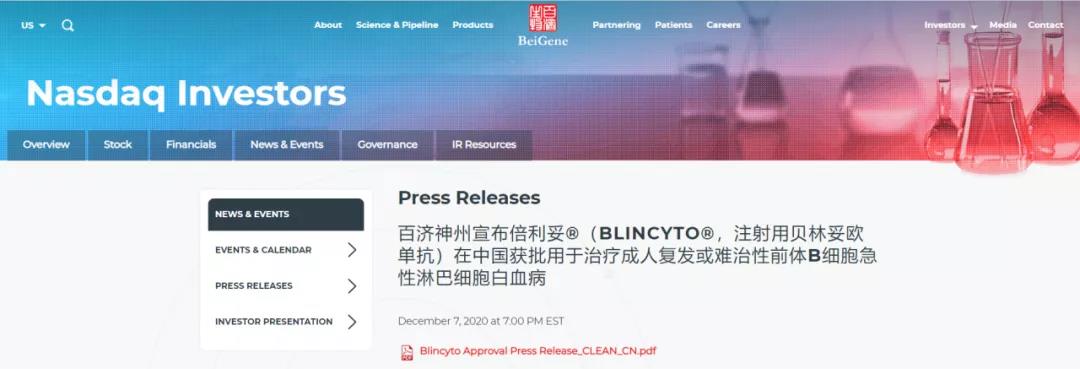
百济神州注射用贝林妥欧单抗在中国获批上市
12月7日,百济神州宣布倍利妥®(BLINCYTO®,注射用贝林妥欧单抗)在中国获批用于治疗成人复发或难治性(R/R)前体B细胞急性淋巴细胞白血病(ALL)。倍利妥®由安进公司开发,百济神州根据双方达成的全球肿瘤战略合作获得其在中国的授权。倍利妥®是中国首款获批的双特异性免疫药物。
https://ir.beigene.com/news-releases/news-release-details-194
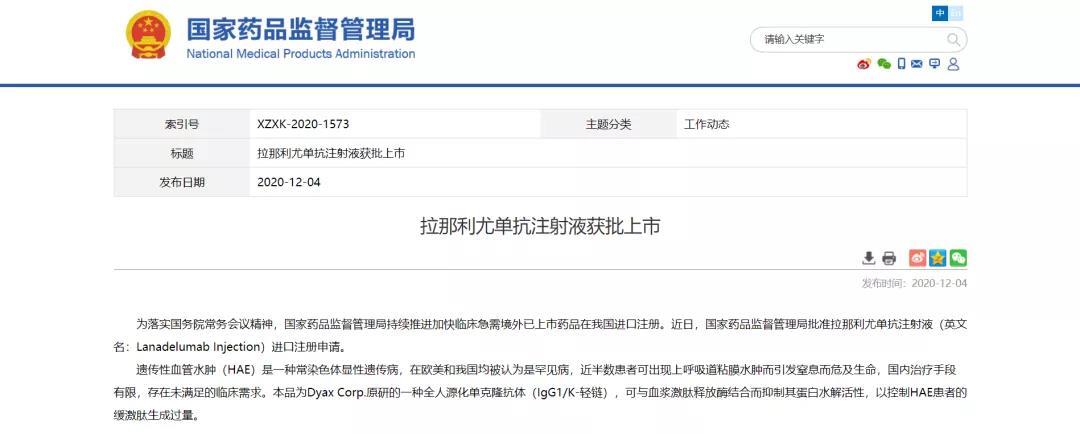
拉那利尤单抗注射液在中国获批上市
为落实国务院常务会议精神,国家药品监督管理局持续推进加快临床急需境外已上市药品在我国进口注册。近日,国家药品监督管理局批准拉那利尤单抗注射液(Lanadelumab Injection)进口注册申请,拟适应症为遗传性血管水肿(HAE)。
https://www.nmpa.gov.cn/yaowen/ypjgyw/20201204163833154.html


