FDA
Zokinvy(lonafarnib)获FDA批准成为首个治疗早衰症的药物
美国FDA于11月20号批准了Eiger BioPharmaceuticals, Inc. 的Zokinvy(lonafarnib)用于减少哈金森-吉尔福德早衰综合征(Hutchinson-Gilford progeria syndrome,HGPS)患者的死亡风险,以及治疗患有特定早老样核纤层蛋白病(processing-deficient progeroid laminopathies)的1岁及以上患者。这是FDA批准的首个早衰症治疗药物。哈金森-吉尔福德早衰综合征是罕见的遗传疾病。患有哈金森-吉尔福德早衰综合征以及特定早老样核纤层蛋白病的患者会加速衰老甚至死亡。大多数病人会在15岁前死于心脏衰竭、心脏病或中风。这种情况的出现主要是由于细胞中累积的有缺陷的早老蛋白或类似早老蛋白的蛋白质,而Zokinvy作为一种法尼基转移酶(farnesyltransferase)抑制剂则可以阻止这种累积从而达到治疗效果。Zokinvy收到FDA授予的孤儿药、突破性疗法、优先审评认定,以及罕见儿科疾病优先审评卷。
https://www.fda.gov/news-events/press-announcements/fda-approves-first-treatment-hutchinson-gilford-progeria-syndrome-and-some-progeroid-laminopathies
Oxlumo(lumasiran)获FDA批准成为首个治疗罕见代谢紊乱的药物
美国FDA于11月23日批准Alnylam Pharmaceuticals, Inc.的Oxlumo(lumasiran)作为治疗I型原发性高草酸尿症(primary hyperoxaluria type 1 ,PH1)的首个药物。PH1是一种罕见的遗传性疾病。患有PH1的病人身体会产生过多的草酸盐,与钙结合后会导致肾结石,从而影响肾脏以及其他重要器官功能 (如心脏、骨、眼睛等)。Oxlumo是一种RNAi药物,主要通过减少肝脏中草酸盐的生成以达到治疗效果。此外,Oxlumo获得了孤儿药和突破性疗法认定, 以及罕见儿科疾病优先审评卷。
https://www.fda.gov/news-events/press-announcements/fda-approves-first-drug-treat-rare-metabolic-disorder
首款靶向CD19的抗体偶联药物获FDA优先审评认定
ADC Therapeutics 11月21日宣布,其创新抗体偶联药物(ADC)loncastuximab tesirine(Lonca)的生物制品上市许可申请(Biologics License Application,BLA)获FDA受理,并获得了优先审评认定。该药物拟用于治疗复发性或难治性弥漫性大B细胞淋巴瘤。
(Loncastuximab tesirine MoA)
信息来源:https://ir.adctherapeutics.com/press-releases/press-release-details/2020/ADC-Therapeutics-Announces-FDA-Accepts-Biologics-License-Application-and-Grants-Priority-Review-for-Loncastuximab-Tesirine-for-Treatment-of-Relapsed-or-Refractory-Diffuse-Large-B-cell-Lymphoma/default.aspx
美国FDA授权首个在家中进行自我测试的COVID-19诊断测试盒
美国FDA在近日通过紧急使用授权(Emergency Use Authorization, EUA),首次批准了在家中进行自我测试的COVID-19诊断试剂盒。Lucira COVID-19一体测试试剂盒是一种分子一次性测试,旨在检测引起COVID-19的新型冠状病毒SARS-CoV-2。 该测试试剂盒是由美国的Lucira Health生产, 目前仅限于处方使用。通过将使用棉签在鼻腔中收集的样本在小瓶中转动,然后将小瓶放入测试器中。在30分钟或更短的时间内,测试器指示灯可显示一个人是SARS-CoV-2病毒阳性还是阴性。
信息来源:
https://www.lucirahealth.com/
NMPA
BMS Opdivo联合Yervoy一线治疗恶性胸膜间皮瘤拟纳入优先审评
11月23日,CDE信息公示,百时美施贵宝PD-1抑制剂纳武利尤单抗和CTLA-4抗体伊匹木单抗联合疗法以“符合附条件批准的药品”拟纳入优先审评,拟开发适应症为:用于治疗初治的不可切除的非上皮样型恶性胸膜间皮瘤成人患者。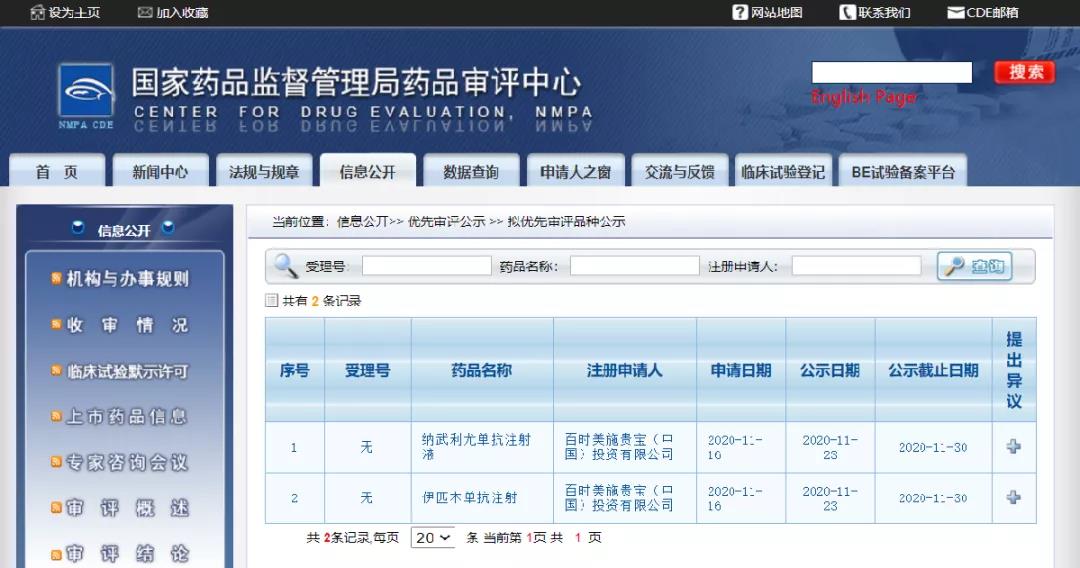
http://www.cde.org.cn/news.do?method=changePage&pageName=service#
CDE正式发布《化学药品创新药I期临床试验申请药学共性问题相关技术要求》和《化学药品I期临床试验申请药学研究信息汇总表(修订版)》
11月23日,CDE正式发布《化学药品创新药I期临床试验申请药学共性问题相关技术要求》和《化学药品I期临床试验申请药学研究信息汇总表(修订版)》,为鼓励创新,加快新药创制,满足公众用药需求。
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=44d5efa0f1ba5fd7
CDE 正式发布《药品审评中心补充资料工作程序(试行)》
11月25日,CDE正式发布《药品审评中心补充资料工作程序(试行)》,对药品注册审评补充资料管理工作做了进一步规范。本程序自2020年12月1日起施行。
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=722d9bbcff708d44
礼来BTK抑制剂获批临床
CDE本周信息公示,礼来申报的I类新药LOXO-305获得两项临床试验默示许可,适应症为:慢性淋巴细胞白血病/小淋巴细胞淋巴瘤、套细胞淋巴瘤、其他B细胞非霍奇金淋巴瘤。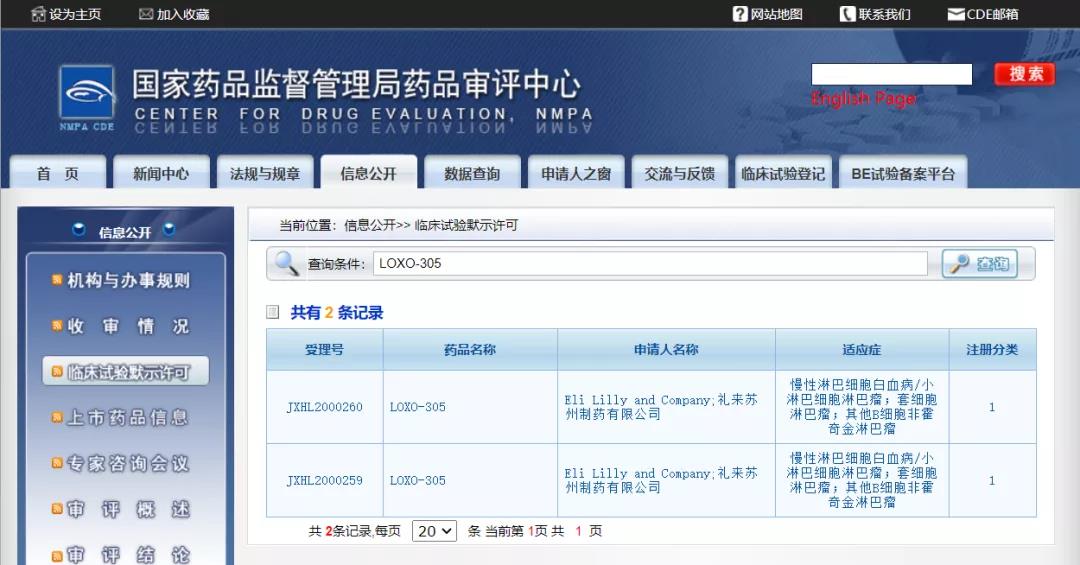
http://www.cde.org.cn/news.do?method=changePage&pageName=service


