FDA
K药与化疗联用治疗三阴性乳腺癌首获FDA加速批准
默沙东于11月14日宣布其PD-1抑制剂Keytruda与化疗联用已获得FDA加速批准,且是K药首次在乳腺癌治疗方面获得FDA的批准。但是该疗法需经FDA批准的检测方法确定肿瘤表达PD-L1的不可切除局部复发性或患者为转移性三阴性乳腺癌后方可使用。在名为KEYNOTE-355的III期临床试验中,患者被分为两组,一组接受Keytruda与化疗构成的组合疗法,另一组则接受安慰剂与化疗构成的组合疗法。最终实验结果表明,死亡风险降低了35%,也正是这一结果使其获得加速批准。

https://www.fda.gov/drugs/resources-information-approved-drugs/hematologyoncology-cancer-approvals-safety-notifications
ViiV Healthcare的Cabotegravir获FDA突破性疗法认定
11月17日,ViiV Healthcare宣布FDA授予其长效整合酶抑制剂Cabotegravir突破性疗法资格,用于HIV暴露前预防。从HPTN 083和084研究获得的数据表明,长效cabotegravir在预防HIV方面优于每日口服FTC / TDF片剂,该研究结果曾在今年7月的第23届国际艾滋病大会上发表。

信息来源:
Kiniksa公司vixarelimab获FDA突破性疗法认定
Kiniksa公司11月17日宣布,美国FDA已授予在研疗法vixarelimab突破性疗法认定,用于治疗与结节性痒疹相关的瘙痒。Vixarelimab是一种全人源单克隆抗体,靶向抑瘤素M受体β。

https://www.kiniksa.com/our-pipeline/vixarelimab/
NMPA
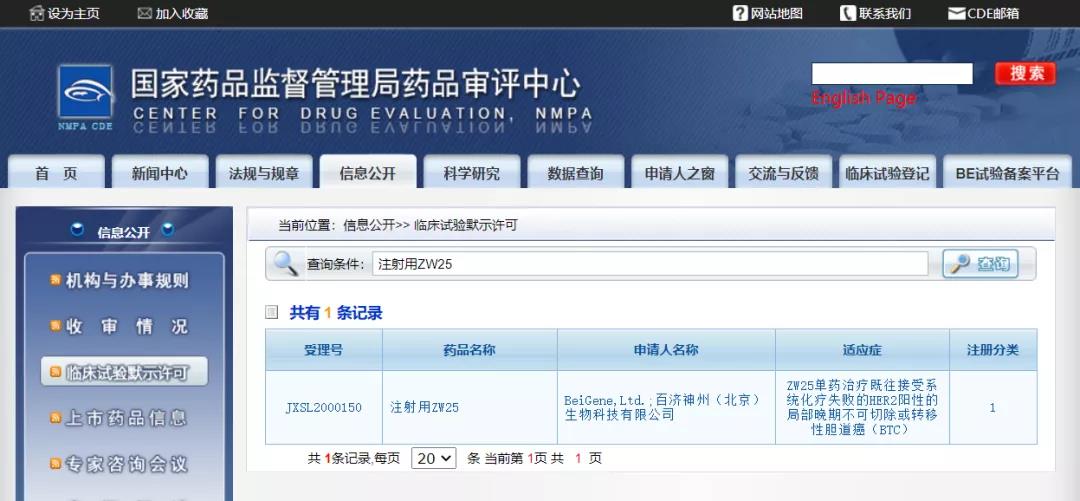
百济神州HER2双抗获批临床
11月16日,CDE公示,百济神州提交的注射用ZW25获得一项临床试验默示许可,针对的适应症为“单药治疗既往接受系统化疗失败的HER2阳性的局部晚期不可切除或转移性胆道癌(BTC)”。
ZW25是一种在研的双特异性抗体,用于潜在治疗HER2表达实体瘤患者。它通过同时结合两个非重叠的HER2表位,即双互补位结合,双重阻断HER2信号,增强结合并去除细胞表面的HER2蛋白。同时,它还具有强有力的抗体效应子功能。
信息来源:
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=25
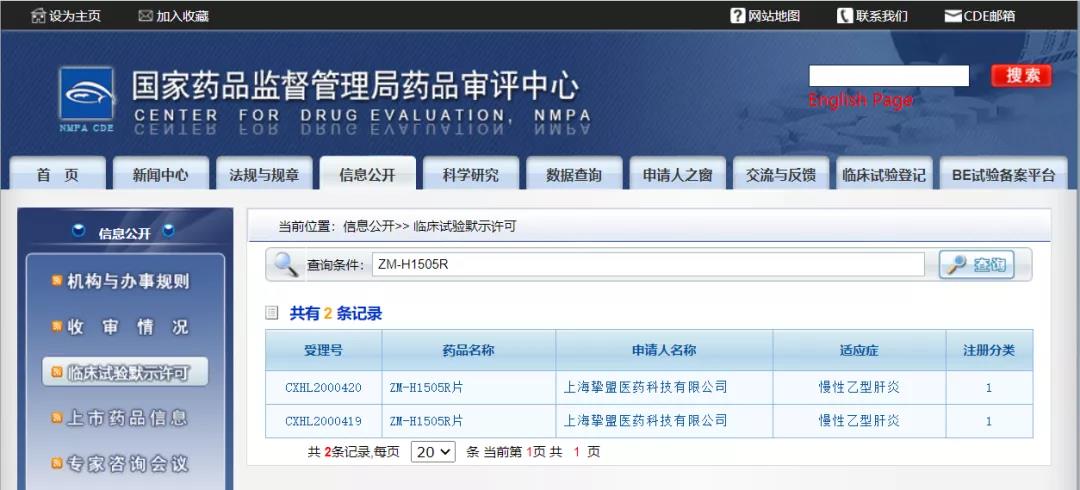
挚盟医药抗乙肝病毒核衣壳抑制剂ZM-H1505R获批临床
11月16日,CDE公示,上海挚盟医药科技有限公司申报的1类新药ZM-H1505R获得临床试验默示许可,针对适应症为“慢性乙型肝炎”。
ZM-H1505R是一种可以有效地抑制HBV核衣壳形成的小分子候选化合物,旨在被开发用于提高慢性乙肝的功能性治愈率。与目前已经报道的I类(杂芳基二氢嘧啶,例如GLS4)和II类(苯基丙烯酰胺或磺酰胺,例如AT-130和NVR3-778)HBV核衣壳抑制剂相比,ZM-H1505R具有全新的化学结构。更重要的是,ZM-H1505R对于对I类和II类HBV核衣壳抑制剂具有耐药性的突变病毒仍然具有良好的抗病毒活性。
信息来源:
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=25
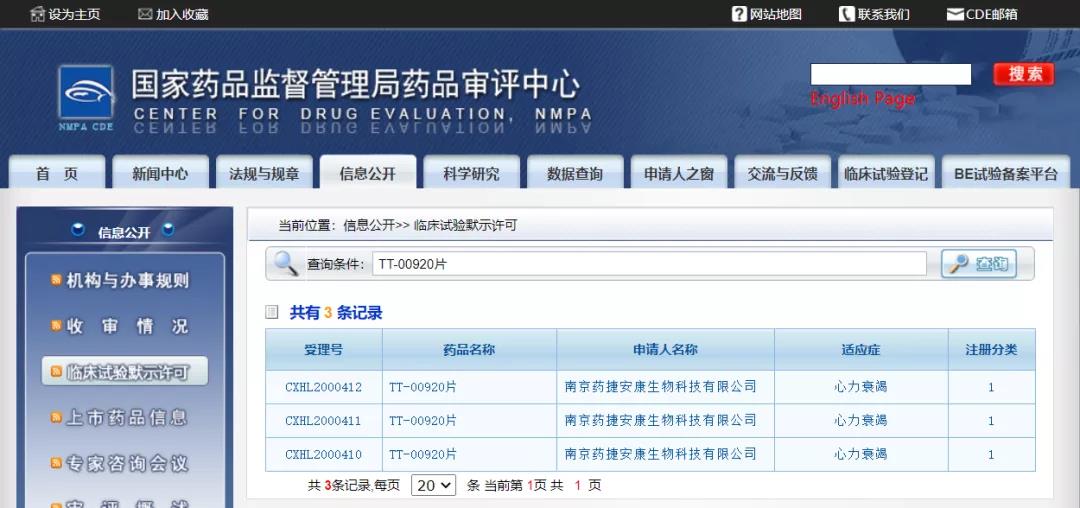
药捷安康PDE9抑制剂在中国获批临床
11月16日,CDE公示,药捷安康的1类新药TT-00920片获得3项临床试验默示许可,针对适应症为“心力衰竭”。据悉,TT-00920已于2019年12月17日在美国获批临床并开始评估TT-00920在健康受试者体内的安全性、耐受性和药代动力学特征。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=25
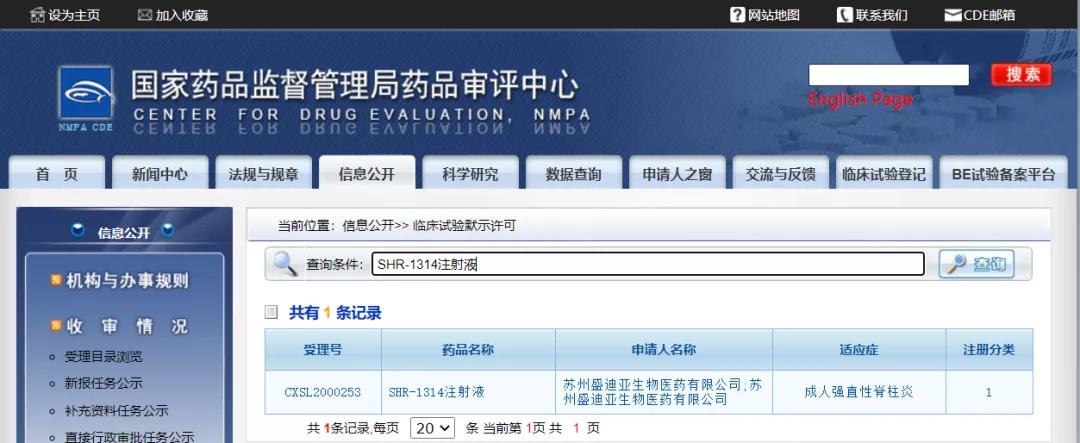
恒瑞SHR-1314单抗获批临床
11月16日,恒瑞医药宣布,其自主研发的1类新药SHR-1314获得NMPA核发的《药物临床试验批准通知书》,准许开展强直性脊柱炎适应症临床试验。在此之前该新药已获得银屑病适应症临床试验许可,且目前已处于临床II期阶段。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=25
贝达药业国产首个ALK抑制剂「恩莎替尼」获批上市
11 月19 日,NMPA 公示,贝达药业 1 类新药盐酸恩莎替尼(CXHS1800045,CXHS1800046)获批上市,成为国产首个自主研发的 ALK 抑制剂。
恩莎替尼主要针对此前接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者。作为新一代ALK抑制剂,恩莎替尼具有强效与高选择性的特点。
(克唑替尼:由辉瑞公司研制的抑制Met/ALK/ROS的ATP竞争性的多靶点蛋白激酶抑制剂)

信息来源:
https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20201119075317120.html
CDE正式发布《药品附条件批准上市技术指导原则(试行)》
11月19日,CDE正式发布《药品附条件批准上市技术指导原则(试行)》,鼓励以临床价值为导向的药物创新,加快具有突出临床价值的临床急需药品上市。

http://www.cde.org.cn/news.do?method=viewInfoCommon&id=e8e70cb03a94e5f2


