FDA
礼来BAMLANIVIMAB紧急使用授权遭FDA撤回
4月16日,Eli Lilly and Co.单克隆抗体药物Bamlanivimab的紧急使用授权(EUA)遭FDA撤回。2020年11月9日,Bamlanivimab获FDA紧急使用授权,用于治疗轻度至中度COVID-19,适用于SARS-CoV-2病毒直接检测结果呈阳性的成人和儿童患者(12岁及以上、体重至少40公斤,约88磅),以及有发展为重度COVID-19和/或住院的高风险的患者。目前,基于后续对其数据的持续分析,特别是Bamlanivimab单独使用时SARS-CoV-2病毒变种的耐药性不断增加从而导致治疗失败的风险增大,FDA认为该药物已知和潜在的收益已经大于相应的风险,因此决定撤销其紧急使用授权。

https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-revokes-emergency-use-authorization-monoclonal-antibody-bamlanivimab?utm_medium=email&utm_source=govdelivery
Bristol-Myers Squibb的OPDIVO®获FDA批准成为首个用于胃癌初始治疗的免疫药物
4月16日,Bristol-Myers Squibb Company的Opdivo ® (nivolumab)获FDA批准,与特定种类的化疗联用治疗晚期或转移性胃癌、胃食管交界癌 (GEJ)以及食管腺癌成人患者。该药物是首个获得FDA批准用于胃癌初始治疗的免疫药物。该适应症曾获得孤儿药和优先审评认定。

https://www.fda.gov/news-events/press-announcements/fda-approves-first-immunotherapy-initial-treatment-gastric-cancer?utm_medium=email&utm_source=govdelivery
Astellas 和Seagen联合开发的PADCEV®新适应症获FDA优先审评认定
4月19日,Astellas Pharma Inc. 和Seagen Inc.联合开发的Padcev® (enfortumab vedotin-ejfv)两项补充生物制品许可申请获FDA优先审评认定,用于治疗局部晚期或转移性尿路上皮癌。
👇 点击查看:
https://www.astellas.com/en/news/16856Amgen的BEMARITUZUMAB获FDA突破性治疗认定
4月19日,Amgen Inc.的Bemarituzumab获FDA突破性治疗认定,联合改良后的FOLFOX6化疗方案(mFOLFOX6:氟嘧啶+亚叶酸+奥沙利铂)治疗FGFR2b过量表达和HER2阴性的转移性和局部晚期胃癌及食管胃结合部GEJ)腺癌。

https://www.amgen.com/newsroom/press-releases/2021/04/amgens-investigational-targeted-treatment-bemarituzumab-granted-breakthrough-therapy-designation
GSK的JEMPERLI获FDA加速批准
4月22日,GlaxoSmithKline的Jemperli(dostarlimab-gxly)获FDA加速批准,用于治疗病情加重或后续使用了铂类化疗的复发性或晚期子宫内膜癌。这类癌症有一个特定的错配修复缺陷dMMR,该基因缺陷影响了细胞内DNA正确修复。
https://www.fda.gov/news-events/press-announcements/fda-approves-immunotherapy-endometrial-cancer-specific-biomarker?utm_medium=email&utm_source=govdelivery
ADC Therapeutics的ZYNLONTA™获FDA加速批准
4月23日,ADC Therapeutics SA的ZynlontaTM(loncastuximab tesirine-lpyl)获FDA加速批准,用于治疗已接受过两种或两种以上系统疗法的复发或难治性大B细胞淋巴瘤(DLBCL)成人患者(包括未明确的DLBCL以及起源于低级别淋巴瘤和高级别B细胞淋巴瘤。

https://www.fda.gov/drugs/fda-grants-accelerated-approval-loncastuximab-tesirine-lpyl-large-b-cell-lymphoma?utm_medium=email&utm_source=govdelivery
Axsome Therapeutics的AXS-05获FDA优先审评认定
4月26日,Axsome Therapeutics, Inc.的AXS-05(dextromethorphan-bupropion)获FDA优先审评认定,用于治疗重度抑郁症。该项申请此前曾获得FDA突破性治疗认定。
https://axsometherapeuticsinc.gcs-web.com/news-releases/news-release-details/axsome-therapeutics-announces-fda-acceptance-and-priority-review
Calliditas Therapeutics的NEFECON获FDA优先审评认定
4月28日,Calliditas Therapeutics AB的Nefecon获FDA优先审评认定,用于治疗IgA肾病(IgAN)。
https://www.calliditas.se/en/fda-grants-priority-review-for-nefecon-for-patients-with-iga-nephropathy-3511/
NMPA
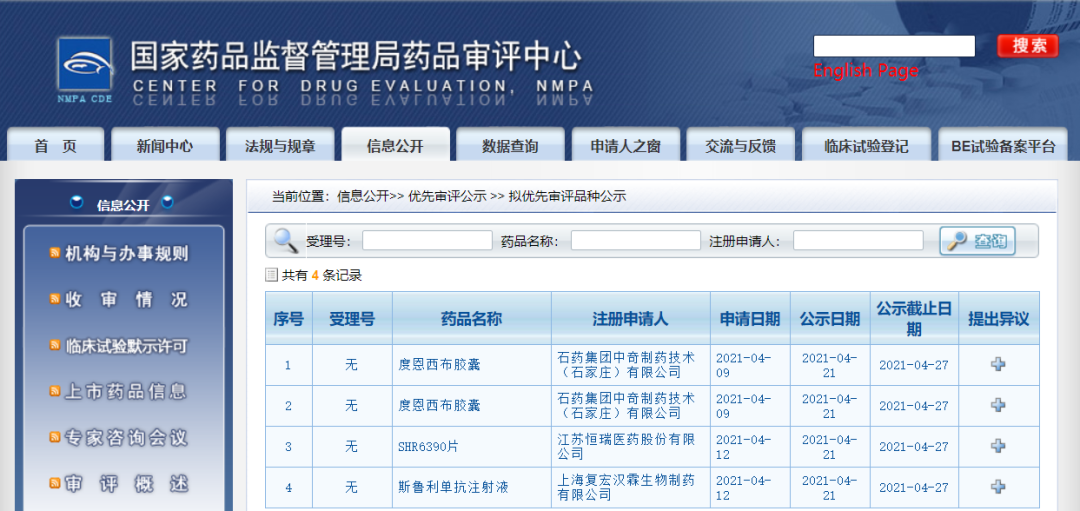
三款药物纳入拟优先审评品种
近日,CDE信息公示,三款药物纳入拟优先审评品种:
1. 石药集团中奇制药技术(石家庄)有限公司的度恩西布胶囊,拟用于治疗既往至少经过两次系统治疗的复发或难治性滤泡性淋巴瘤(FL);
2. 江苏恒瑞医药股份有限公司的SHR6390片,拟联合氟维司群治疗激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的经内分泌治疗后进展的复发或转移性乳腺癌;
3. 上海复宏汉霖生物制药有限公司的斯鲁利单抗注射液,拟联合治疗经过标准治疗失败的、不可切除或转移性高度微卫星不稳定型(Microsatellite Instability-High,MSI-H)实体瘤。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20
药审中心举办ICH指导原则实施情况宣讲会
4月9日,CDE信息公示,力品药业(厦门)股份有限公司的盐酸可乐定缓释片纳入拟优先审评品种,拟用于单独或辅助兴奋剂药物治疗6~17岁儿童和青少年的注意缺陷多动障碍(多动症,ADHD)。
为推动ICH指导原则在国内的转化实施工作,由国家药品监督管理局药品审评中心主办的“ICH指导原则实施情况宣讲会”于2021年4月28日以线上直播方式举办。此次宣讲会内容主要介绍了ICH工作进展情况、Q、S系列指导原则的实施情况及其影响,并围绕E9(R1)指导原则的技术要求和落地实施情况进行了宣贯,旨在加强监管机构、工业界和学界人员对ICH技术指导原则的理解。
宣讲会直播视频回放链接:http://live.xylink.com/live/v/Eky6tLOf
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=6f2815a969cd06b2


