FDA
FDA对未能向美国临床试验数据库递交试验结果信息的企业将采取惩罚措施
近日,由于Acceleron Pharma, Inc. (Acceleron)未能向美国临床试验数据库(ClinicalTrials.gov data bank)提交试验结果信息,FDA根据《美国食品药品监督管理局2007 年修正法案》(FDAAA)与《美国公共卫生服务法案》(PHS法案)的要求,针对Acceleron已经完成的临床II期试验(用于评价Dalantercept与Axitinib联用治疗晚期肾细胞癌的疗效与安全性)向其发出首个不合规通知 (Notice of Noncompliance)。通知中要求Acceleron 在收到该通知的30天内(即5月27日之前)递交相关临床试验结果信息。同时,FDA获得了对Acceleron违规行为处以民事罚款的授权(不超过1万美金),还包括如果Acceleron在30天期限内未能递交所需信息的额外罚款(即在违规行为发生后持续的每一天,加收不超过每天1万美金的民事罚款,直至递交所有信息)。

https://www.fda.gov/news-events/press-announcements/fda-takes-action-failure-submit-required-clinical-trial-results-information-clinicaltrialsgov?utm_medium=email&utm_source=govdelivery
AstraZeneca的FARXIGA获FDA批准上市
近日,AstraZeneca的Farxiga(dapagliflozin)获FDA批准上市,用于降低慢性肾病成人患者(病情有加重的风险)肾功能减退、肾衰竭、心血管疾病致死以及心衰住院的风险。该申请曾获得快速通道、突破性治疗以及优先审评认定。

👇 点击查看:
https://www.fda.gov/news-events/press-announcements/fda-approves-treatment-chronic-kidney-disease?utm_medium=email&utm_source=govdeliveryMerck的KEYTRUDA ®新适应症获FDA加速批准
5月5日,Merck & Co.的Keytruda®(pembrolizumab)获FDA加速批准,用于与曲妥珠单抗(trastuzumab)、氟嘧啶类和铂类化疗联用治疗局部晚期不可切除或转移性、HER2阳性的胃癌或胃食管交界(GEJ)腺癌。该申请曾获得优先审评认定。

👇 点击查看:
https://www.fda.gov/drugs/drug-approvals-and-databases/fda-grants-accelerated-approval-pembrolizumab-her2-positive-gastric-cancer?utm_medium=email&utm_source=govdeliveryNMPA
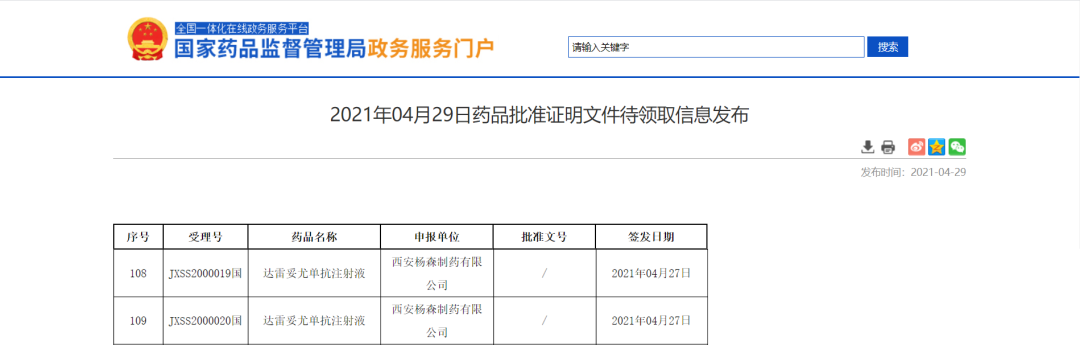
杨森制药达雷妥尤单抗新适应症获NMPA批准
近日,NMPA信息公示,西安杨森制药有限公司的达雷妥尤单抗注射液新适应症获NMPA批准,用于与来那度胺和地塞米松联合用药或与硼替佐米和地塞米松联合用药治疗既往至少接受过一线治疗的多发性骨髓瘤成年患者。
👇 点击查看:
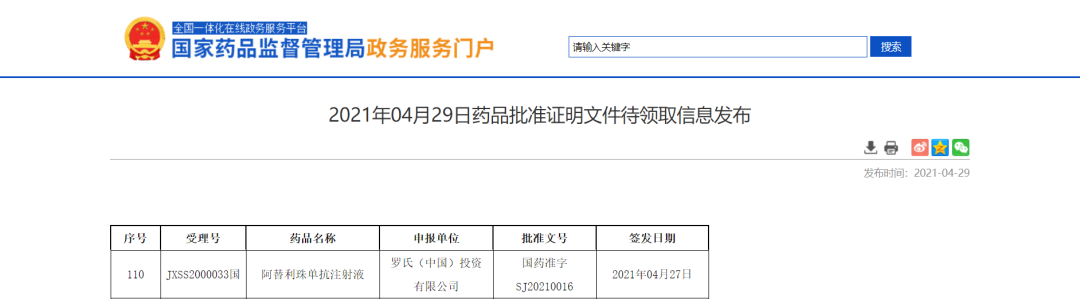
https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20210429162506168.html罗氏阿替利珠单抗新适应症获NMPA批准
近日,NMPA信息公示,罗氏(中国)投资有限公司的阿替利珠单抗注射液新适应症获NMPA批准,用于单药治疗PD-L1 阳性、表皮生长影子受体(EGFR)和间变性淋巴瘤激酶(ALK)阴性的转移性非小细胞肺癌(NSCLC)患者的一线治疗。
👇 点击查看:
https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20210429162506168.html

