FDA
ARCALYST ®获FDA批准成为首个治疗复发性心包炎的药物
近日,Kiniksa Pharmaceuticals, Ltd.的Arcalyst ®(rilonacept)获FDA批准,用于治疗复发性心包炎的成人和12岁及以上儿童患者并降低复发风险。Arcalyst ®是FDA批准的首个治疗复发性心包炎的药物,且获得了孤儿药资格认定。

https://www.fda.gov/drugs/drug-safety-and-availability/fda-approves-first-treatment-disease-causes-recurrent-inflammation-sac-surrounding-heart?utm_medium=email&utm_source=govdelivery
KEYTRUDA®获FDA批准用于治疗食道癌和胃食管交界癌
3月22日,Merck Sharp & Dohme Corp.的Keytruda®(pembrolizumab)获FDA批准,与铂类和氟嘧啶类化疗联合用于治疗不适合手术切除或确定性化学放疗的转移性或局部晚期食道癌或者胃食管结合部(GEJ)腺癌患者。该申请曾获得优先审评认定。
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-pembrolizumab-esophageal-or-gej-carcinoma?utm_medium=email&utm_source=govdelivery
Zealand Pharma的ZEGALOGUE®获FDA批准
3月22日,Zealand Pharma A/S,Inc.的Zegalogue® (dasiglucagon)获FDA批准,用于治疗6岁及以上儿童和成人糖尿病患者的严重低血糖。
http://www.globenewswire.com/news-release/2021/03/22/2197267/0/en/Zealand-Pharma-Announces-FDA-Approval-of-Zegalogue-dasiglucagon-injection-for-the-Treatment-of-Severe-Hypoglycemia-in-People-with-Diabetes.html
NMPA
国家药监局附条件批准普拉替尼胶囊上市
近日,国家药品监督管理局通过优先审评审批程序附条件批准Blueprint Medicines Corporation申报的1类创新药普拉替尼胶囊 (普吉华®)上市,用于既往接受过含铂化疗的转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。

https://www.nmpa.gov.cn/yaowen/ypjgyw/20210324140443175.html
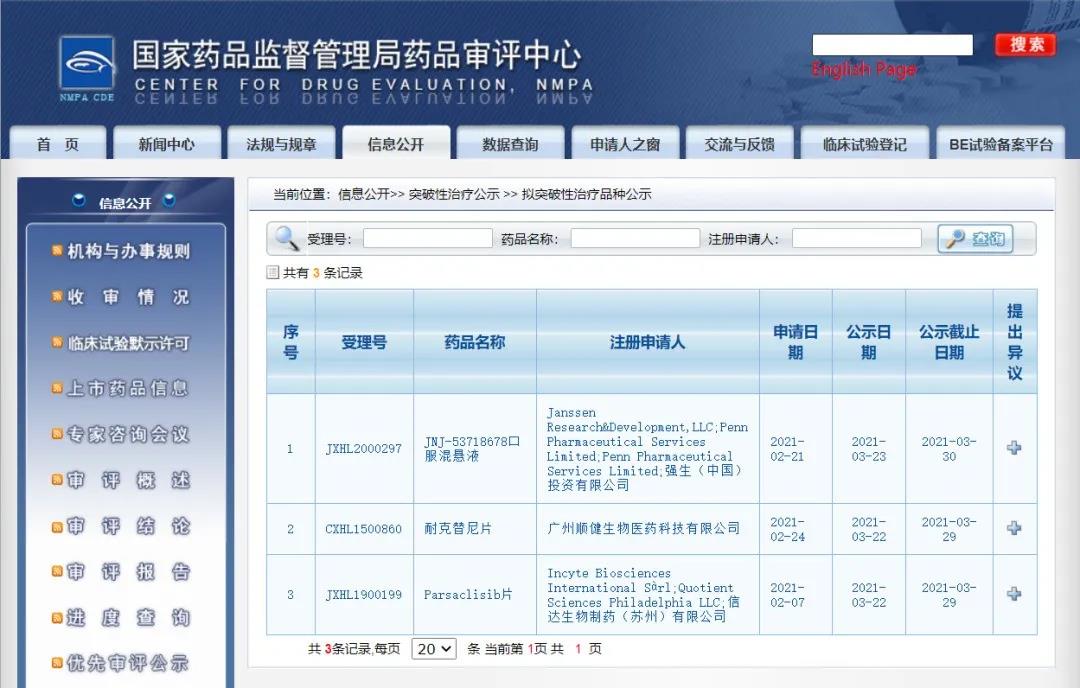
三款药物纳入拟突破性治疗品种
近日,CDE信息公示,三款药物纳入拟突破性治疗品种:1. 信达生物制药(苏州)有限公司的Parsaclisib片,拟定适应症为复发性或难治性滤泡性淋巴瘤;
2. 广州顺健生物医药科技有限公司的耐克替尼片,拟用于治疗一代和二代酪氨酸激酶抑制剂耐药和/或不耐受的慢性期慢性髓性白血病患者;
3. 强生(中国)投资有限公司的JNJ-53718678口服混悬液,拟定适应症为儿童呼吸道合胞病毒(RSV)所致中重度呼吸道感染。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=26


