FDA
Melinta的KIMYRSA™获FDA批准上市
3月15日,Melinta Therapeutics, LLC的Kimyrsa™ (Oritavancin)获FDA批准上市,用于治疗由特定革兰氏阳性微生物(包括耐甲氧西林金黄色葡萄球菌)的敏感分离物引起的急性细菌性皮肤和皮肤结构感染的成人患者。

https://melinta.com/melinta-therapeutics-announces-fda-approval-of-kimyrsa-oritavancin-for-the-treatment-of-adult-patients-with-acute-bacterial-skin-and-skin-structure-infections-absssi/
Merck的BELZUTIFAN获FDA优先审评认定
3月16日,Merck & Co., Inc.的Belzutifan获FDA优先审评认定,用于治疗无需立即手术的、与希佩尔·林道综合征(Von Hippel-Lindau disease,VHL)相关的肾透明细胞癌患者。
https://www.merck.com/news/merck-receives-priority-review-from-fda-for-new-drug-application-for-hif-2%ce%b1-inhibitor-belzutifan-mk-6482/
NMPA
CDE正式发布《创新药(化学药)临床试验期间药学变更技术指导原则(试行)》
3月12日,CDE公告,为进一步配合《药品管理法》《药品注册管理办法》中关于创新药相关政策贯彻实施,在国家药品监督管理局的部署下,药审中心发布了《创新药(化学药)临床试验期间药学变更技术指导原则(试行)》。

http://www.cde.org.cn/news.do?method=viewInfoCommon&id=f56cc94fcc7ba86b
优替德隆注射液获NMPA批准上市
3月15日,NMPA公告,成都华昊中天药业有限公司申报的1类创新药优替德隆(优替帝®)注射液通过优先审评审批程序获批上市,拟用于既往接受过至少一种化疗方案的复发或转移性乳腺癌患者。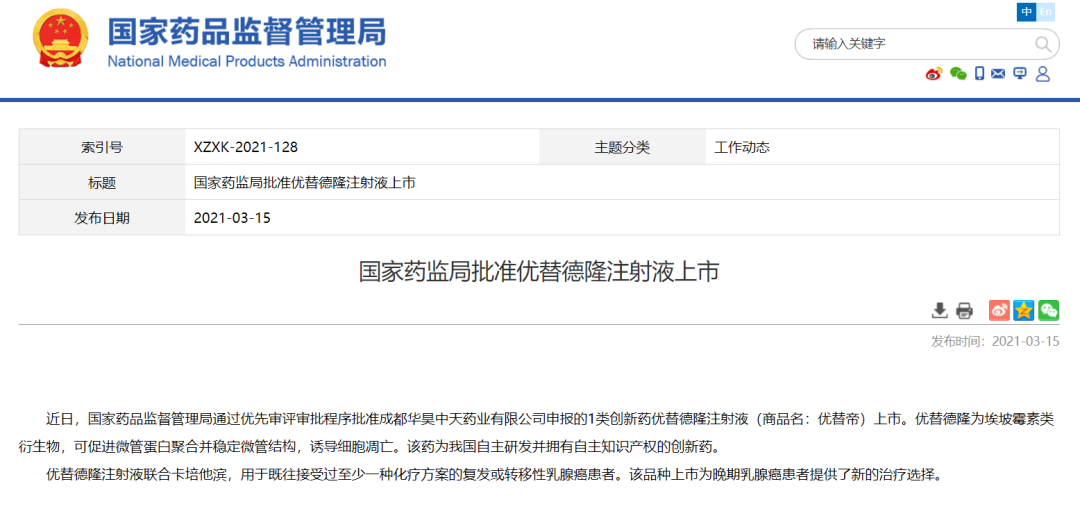
https://www.nmpa.gov.cn/yaowen/ypjgyw/20210315101202130.html
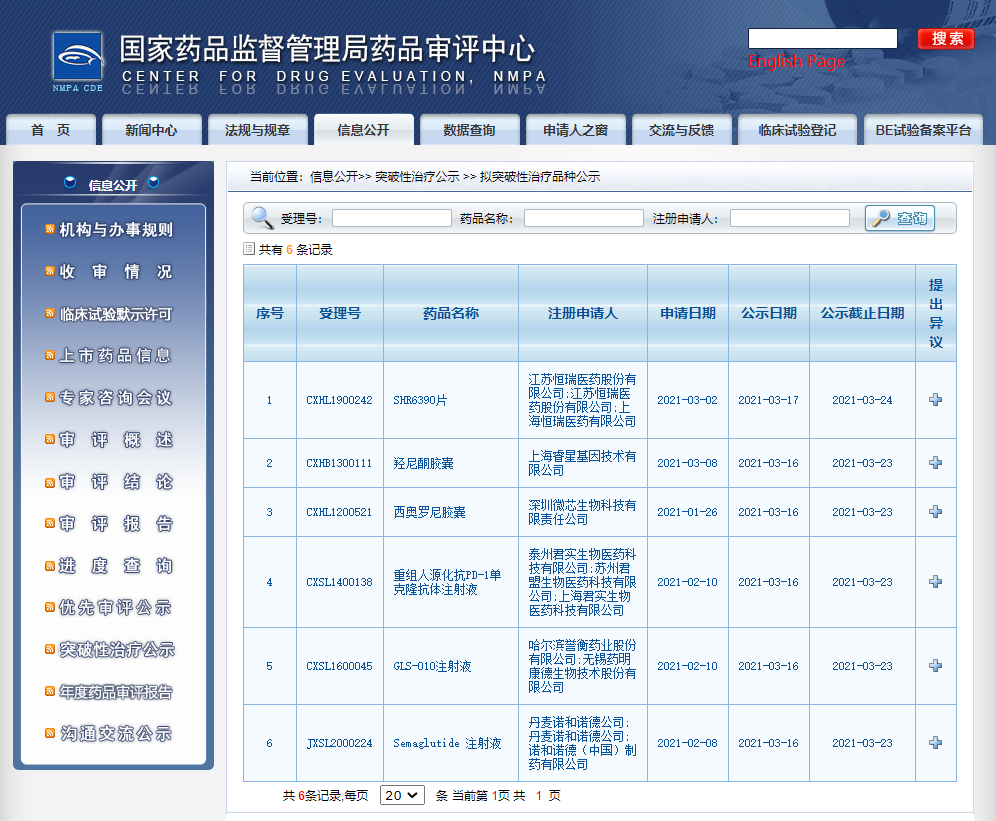
六款药物纳入拟突破性治疗品种
近日,CDE信息公示,六款药物纳入拟突破性治疗品种:1. 江苏恒瑞医药股份有限公司的SHR6390片,拟定适应症为联合氟维司群用于经内分泌治疗后进展的激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的复发或转移性乳腺癌;
2. 上海睿星基因技术有限公司的羟尼酮胶囊,拟用于治疗慢性乙型肝炎肝纤维化;
3. 深圳微芯生物科技有限责任公司的西奥罗尼胶囊,拟用于联合紫杉醇周疗治疗铂难治或铂耐药复发卵巢癌;
4. 上海君实生物医药科技有限公司的重组人源化抗PD-1单克隆抗体注射液,拟用于晚期黏膜黑色素瘤的一线治疗;
5. 哈尔滨誉衡药业股份有限公司的GLS-010注射液,拟用于治疗接受过一线或以上含铂标准化疗后进展的复发或转移、PD-L1表达阳性(CPS≥1)宫颈癌;
6. 诺和诺德(中国)制药有限公司的Semaglutide(司美格鲁肽)注射液,拟用于非酒精性脂肪性肝炎(NASH)的治疗。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20#
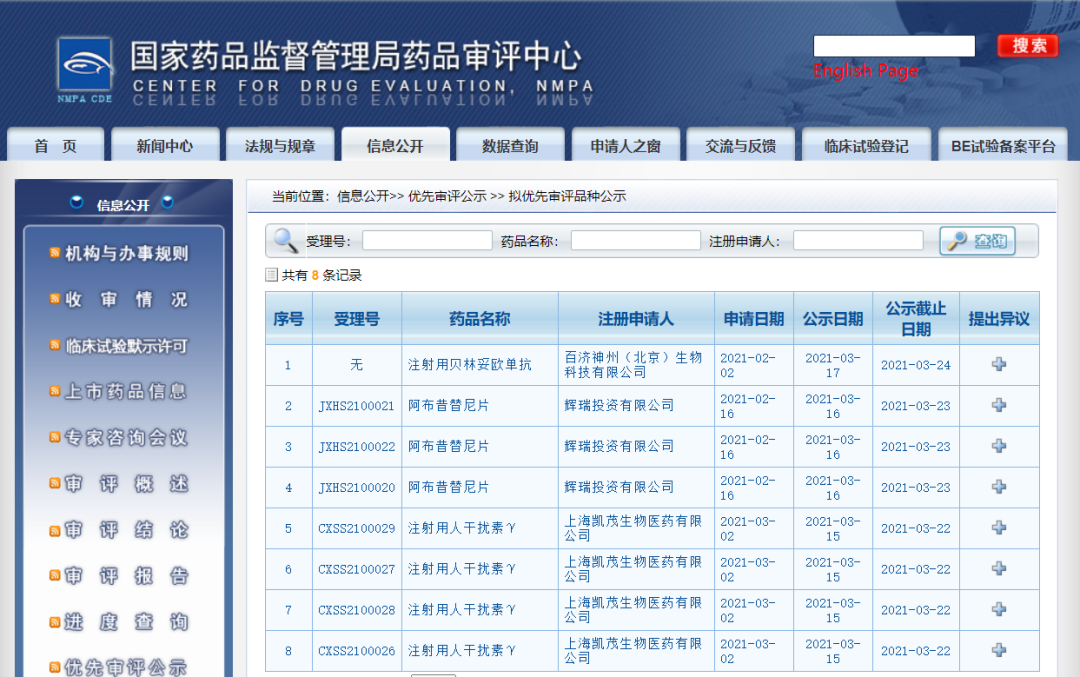
三款药物纳入拟优先审评品种
近日,CDE信息公示,三款药物纳入拟优先审评品种:1. 上海凯茂生物医药有限公司的注射用人干扰素γ(规格:100万IU,200万IU),拟定适应症为:①类风湿性关节炎;②肝纤维化;③孟德尔遗传分枝杆菌易感性疾病;④慢性肉芽肿病;
2. 辉瑞投资有限公司的阿布昔替尼片(规格:50 mg, 100 mg, 200 mg),拟用于对外用治疗反应不佳或不适合这些治疗的 12 岁及以上中至重度特应性皮炎患者的治疗,包括缓解瘙痒。阿布昔替尼可联合或不联合外用治疗;
3. 百济神州(北京)生物科技有限公司的注射用贝林妥欧单抗,拟用于治疗成人及儿童复发或难治性前体B细胞急性淋巴细胞白血病。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20#


