FDA
Kite Pharma的YESCARTA®新适应症获FDA加速批准
3月5日,Kite Pharma, Inc.的Yescarta®(axicabtagene ciloleucel)获FDA加速批准,用于接受过两种及以上系统治疗的复发或难治性滤泡性淋巴瘤(FL)的成人患者。该申请还获得了FDA孤儿药、突破性疗法和优先审评认定。

https://www.fda.gov/drugs/drug-approvals-and-databases/fda-grants-accelerated-approval-axicabtagene-ciloleucel-relapsed-or-refractory-follicular-lymphoma?utm_medium=email&utm_source=govdelivery
Roche的ACTEMRA®/ROACTEMRA®新适应症获FDA批准
3月5日,Roche, Inc.的Actemra®/RoActemra® (tocilizumab)新适应症获FDA批准,用于延缓系统性硬化症相关间质性肺病(SSc-ILD)成人患者肺功能下降的速度。Actemra®/RoActemra®是首个获得FDA批准治疗该疾病的生物药。该申请此前还获得了优先审评认定。
https://www.roche.com/media/releases/med-cor-2021-03-05b.htm
Cara Therapeutics 和Vifor Pharma合作开发的KORSUVA™获FDA优先审评认定
3月8日,Cara Therapeutics,Inc 和 Vifor Pharma,Inc合作开发的Korsuva™ ( difelikefalin)获得FDA优先审评认定,用于治疗血液透析患者的中度至重度瘙痒。
AVEO Pharmaceuticals的FOTIVDA®获FDA批准上市
3月10日,AVEO Pharmaceuticals, Inc的Fotivda®(tivozanib)获FDA批准,用于既往接受过两种或两种以上系统治疗的复发或难治性晚期肾细胞癌(RCC)的成人患者。Fotivda是一种口服血管内皮生长因子(VEGF)受体酪氨酸激酶抑制剂(TKI),也是被批准用于该类晚期肾细胞癌患者的首个治疗方法。

https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-tivozanib-relapsed-or-refractory-advanced-renal-cell-carcinoma
NMPA
CDE正式发布《境外已上市境内未上市化学药品药学研究与评价技术要求(试行)》
3月8日,CDE正式公告,为进一步指导企业开展药品研发,加快境外已上市境内未上市化学药品研发上市进程,提供可参考的技术标准,药审中心发布了《境外已上市境内未上市化学药品药学研究与评价技术要求(试行)》。

http://www.cde.org.cn/news.do?method=viewInfoCommon&id=22e22f0726b4910c
荣昌生物注射用泰它西普在中国获批上市
3月9日,NMPA信息公示,荣昌生物1类新药注射用泰它西普获批上市,为靶向B淋巴细胞刺激因子(BLyS)和增殖诱导配体(APRIL)的原创性抗体融合蛋白药物,用于治疗系统性红斑狼疮(SLE)。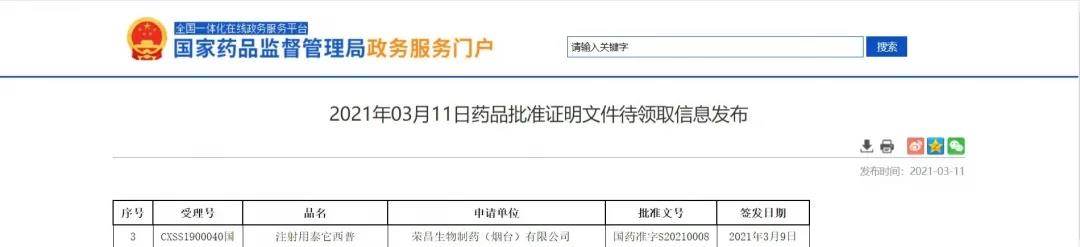
https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20210311082859145.html?GXMEUwefOdZn=1615426867932


