FDA
FDA正式发布2021年度指导原则工作计划
近日,FDA发布了2021 年药物评价与研究中心(CDER)指导原则制定与发布的工作计划。根据指导原则发布计划, CDER将在今年发布多份与临床试验相关的指导原则, 其中涉及多个临床终点、安全性报告中临床试验研究者与申报人的责任、分散式临床试验(Decentralized Clinical Trials)、数据监查委员会(Data Monitoring Committee)以及在临床试验研究中采用数字化健康技术进行远程数据采集。同时, CDER也会进一步说明关于真实世界数据(Real-world Data, RWD)和真实世界证据(Real-world Evidence, RWE)以及电子记录与签名的使用。

https://bit.ly/3acExhE.
紧急使用授权(EUA)授权的药物、生物制剂不会被视为在研药物
1月27 日,FDA更新了关于医疗产品在新冠肺炎(COVID-19) 期间进行临床试验的指导原则。 该指导原则明确指出,接种了获得FDA紧急使用授权(EUA)的COVID-19疫苗的个人不需要从其他临床试验中排除。该指导原则进一步阐明了FDA的政策-即防止临床试验的受试者入组前已受试其他疗效与安全性尚未得到证实的在研产品。在COVID-19大流行期间,获得EUA的药物、生物制剂和医疗器械不会被FDA视为在研产品。
https://bit.ly/39tUy3z.
CABENUVA®(cabotegravir and rilpivirine)获FDA批准成为首个用于HIV成年患者的缓释注射液
近日,ViiV Healthcare的Cabenuva®(cabotegravir and rilpivirine)获FDA批准用于成人人免疫缺陷病毒1型(HIV-1)感染,适用于无治疗失败史,并且对卡博特韦和利匹韦林出现耐药性的患者,该注射液可以取代其目前使用的抗逆转录病毒疗法(每月给药一次)。此外,FDA还批准了Vocabria (cabotegravir, tablet formulation),拟在接受Cabenuva治疗前的一个月与口服rilpivirine (Edurant)联合使用以确保患者良好的药物耐受性。Cabenuva®是首个获得FDA批准的完全用于HIV成年患者的注射剂,同时还获得了快速通道和优先审评认定。
https://www.fda.gov/news-events/press-announcements/fda-approves-first-extended-release-injectable-drug-regimen-adults-living-hiv?utm_medium=email&utm_source=govdelivery
Albireo Pharma公司 ODEVIXIBAT获FDA优先审评认定
1月25日,Albireo Pharma, Inc.宣布FDA已受理其Odevixibat的新药申请并授予优先审评认定。Odevixibat拟用于进行性家族性肝内胆汁淤积症(PFIC)患者的瘙痒,每日单次口服用药。
https://ir.albireopharma.com/news-releases/news-release-details/albireo-announces-us-fda-acceptance-new-drug-application
Immunicum AB公司Ilixadencel获FDA孤儿药认定
1月28日,Immunicum AB公司宣布其先导候选疗法ilixadencel获FDA孤儿药认定,拟用于软组织肉瘤(Soft Tissue Sarcoma,STS)。Ilixadencel是一种基于细胞的通用型癌症免疫触发剂(off-the-shelf immune primer)。
https://immunicum.se/investors/press-releases/press/?xml_id=2163957
NMPA
国际人用药品注册技术协调会指导原则E9(R1)、S5(R3)与S11适用
1月25日,为推动药品注册技术标准与国际接轨,国家药品监督管理局发布公告决定适用《E9(R1):临床试验中的估计目标与敏感性分析》与《S5(R3):人用药物生殖与发育毒性检测》和《S11:支持儿科药物开发的非临床安全性评价》国际人用药品注册技术协调会(ICH)指导原则。自公告发布之日起,S5(R3)和S11 适用;12个月后启动的药物临床研究适用E9(R1)。
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20210125153350133.html

https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20210125153107196.html
CDE正式发布《药物相互作用研究技术指导原则(试行)》
1月26日,CDE发布信息,为进一步鼓励和引导申请人高效规范地开展药物相互作用研究工作,药审中心发布了《药物相互作用研究技术指导原则(试行)》。
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=cc85bdbe69af7f7a
CDE正式发布《药物临床试验适应性设计指导原则(试行)》
1月29日,CDE发布信息,为规范和统一国内对适应性设计的认识,促进适应性设计的应用和理解以提高研发效率,药审中心发布了《药物临床试验适应性设计指导原则(试行)》。
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=768744135afea3cc
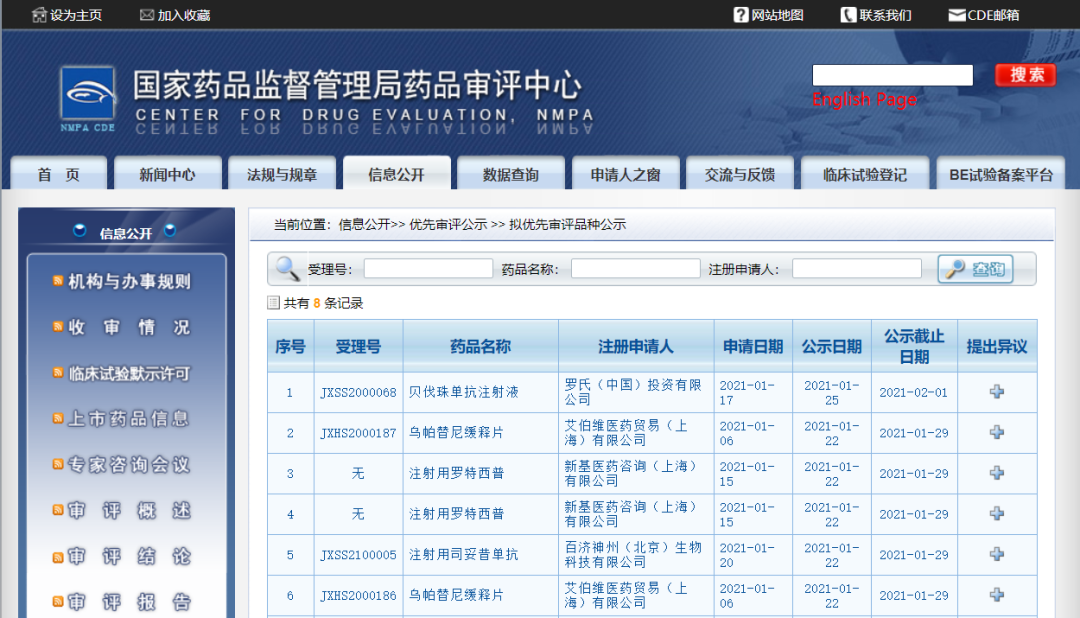
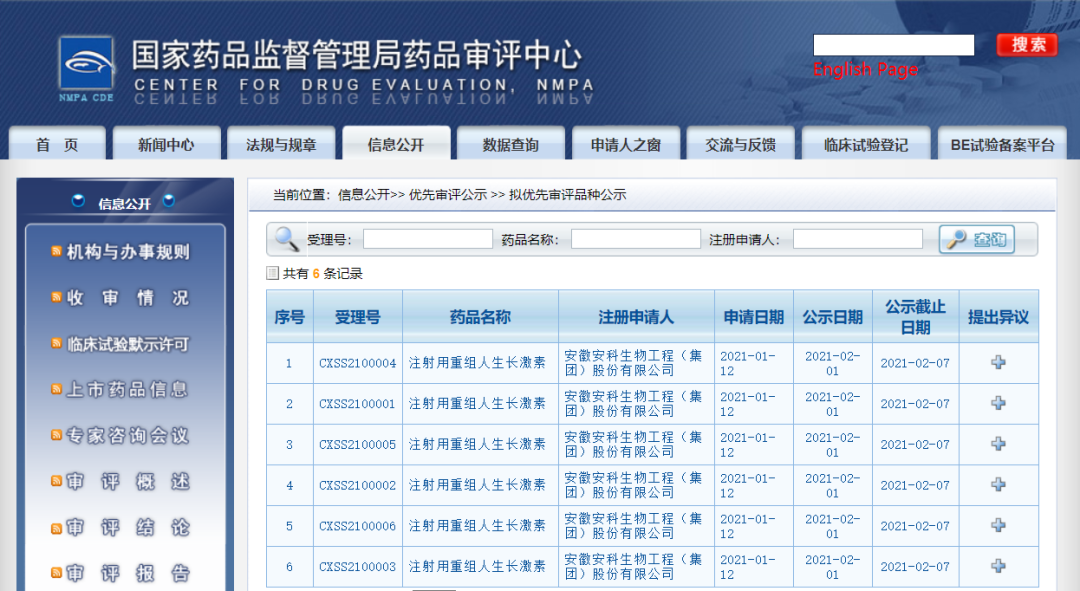
五款药物纳入拟优先审评品种
近日,CDE信息公示,五款药物纳入拟优先审评品种:1.艾伯维医药贸易(上海)有限公司的乌帕替尼缓释片(15mg和30mg规格),拟用于适合系统性治疗的成人和12岁及12岁以上青少年中重度特应性皮炎患者。
2.百济神州(北京)生物科技有限公司的注射用司妥昔单抗,拟用于治疗人类免疫缺陷病毒(HIV)阴性和人类疱疹病毒8(HHV-8)阴性的多中心卡斯特曼(Castleman)病成年患者。
3.新基医药咨询(上海)有限公司的注射用罗特西普,拟用于治疗需要定期输注红细胞(RBC)的成人β-地中海贫血患者。
4.罗氏(中国)投资有限公司的贝伐珠单抗注射液,拟用于联合阿替利珠单抗治疗既往未接受过全身系统性治疗的不可切除肝细胞癌患者。
5.安徽安科生物工程(集团)股份有限公司的注射用重组人生长激素,共六个规格:6IU/2mg/支、2IU/0.67mg/支、10IU/3.33mg/支、4IU/1.33mg/支、 16IU/5.33mg/支以及4.5IU/1.5mg/支,拟用于特发性矮小症。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=21#
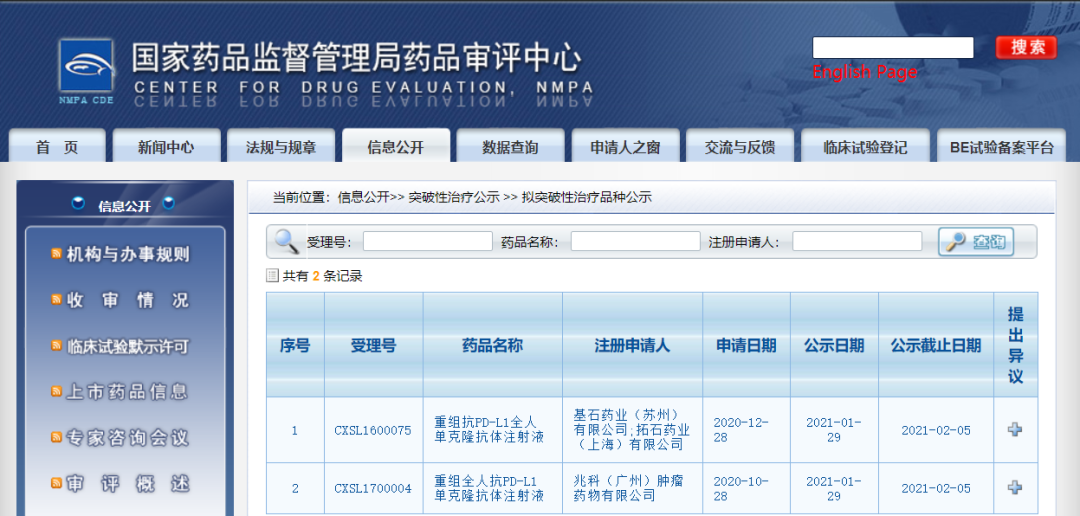
两款药物纳入拟突破性治疗品种
近日,CDE信息公示,两款药物纳入拟突破性治疗品种:1.基石药业(苏州)有限公司的重组抗PD-L1全人单克隆抗体注射液,拟用于复发或难治性结外自然杀伤细胞/T细胞淋巴瘤(R/R ENKTL)。
2.兆科(广州)肿瘤药物有限公司的重组全人抗PD-L1单克隆抗体注射液,拟用于接受过一线含铂方案失败或者不能耐受的复发转移性宫颈癌。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=26#
信达生物信迪利单抗注射液与海思科制药的环泊酚乳状注射液新适应症在中国获批
2月2日,NMPA信息公示,由信达生物和礼来制药联合开发的创新药物PD-1抑制剂达伯舒®(信迪利单抗注射液)正式获得国家药品监督管理局的批准,联合培美曲塞和铂类化疗用于非鳞状非小细胞肺癌(nsqNSCLC)的一线治疗;同时获批的还有辽宁海思科制药有限公司的环泊酚乳状注射液,拟用于全身麻醉诱导适应症。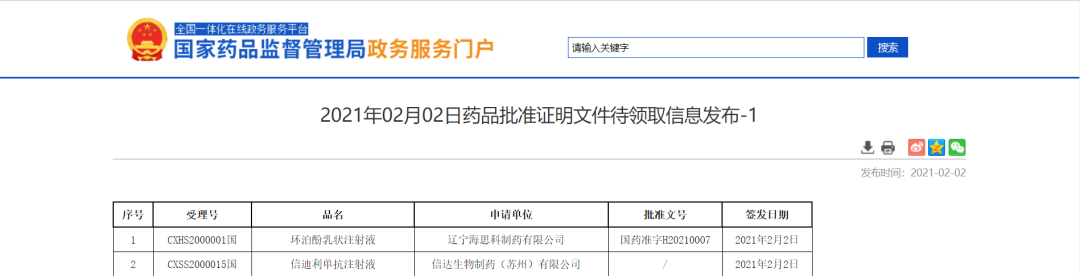
https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20210202223610138.html


