FDA
辉瑞XALKORI® (CRIZOTINIB)获FDA批准
1月14日,辉瑞(Pfizer, Inc.)XALKORI® (crizotinib)补充新药申请获得FDA批准,用于治疗复发或难治性系统间变性大细胞淋巴瘤(ALK阳性,间变性淋巴瘤激酶阳性)一岁及以上的儿童患者和年轻患者。该申请获得了优先审评、突破性治疗以及孤儿药认定。

https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-crizotinib-children-and-young-adults-relapsed-or-refractory-systemic-anaplastic-large?utm_medium=email&utm_source=govdelivery
DARZALEX FASPRO®(达雷妥尤单抗-透明质酸酶)获FDA加速批准
1月15日,杨森制药(Jansen Biotech, Inc.)DARZALEX FASPRO®(达雷妥尤单抗-透明质酸酶)获FDA加速批准与硼替佐米(Bortezomib)、环磷酰胺(Cyclophosphamide,CTX)和地塞米松(Dexamethasone,DXMS)联合使用治疗新诊断的轻链型淀粉样变性的成人患者。DARZALEX FASPRO®是首个获FDA批准用于轻链型淀粉样变性的药物。
https://www.fda.gov/drugs/drug-approvals-and-databases/fda-grants-accelerated-approval-darzalex-faspro-newly-diagnosed-light-chain-amyloidosis
第一三共制药ENHERTU®获FDA批准
1月15日,第一三共制药(Daiichi Sankyo)研发的Enhertu (fam-trastuzumab deruxtecan-nxki)获FDA批准用于治疗HER2阳性局部晚期或转移性胃癌和胃食管结合部(GEJ)腺癌,适用于此前接受过基于trastuzumab疗法治疗的成年患者。该药是第一三共制药和阿斯利康(AstraZeneca)合作研发的,曾获FDA优先审评、突破性治疗以及孤儿药认定。
https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-fam-trastuzumab-deruxtecan-nxki-her2-positive-gastric-adenocarcinomas
默沙东新药VERQUVO®获FDA批准上市
1月20日,默沙东开发的可溶性鸟苷酸环化酶(sGC)激动剂Verquvo(vericiguat) 获FDA批准上市,拟用于降低由于心血管病死亡以及心衰住院治疗后由于心衰再次住院或者需要在门诊静脉注射利尿剂的风险,适用于伴有症状且射血分数小于45%的成人慢性心衰患者。
https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=BasicSearch.process
NMPA
协和麒麟布罗索尤单抗注射液获NMPA附条件批准上市
1月15日,NMPA信息公示,国家药品监督管理局通过优先审评审批程序附条件批准了协和麒麟(中国)制药有限公司(Kyowa Kirin Inc.)的布罗索尤单抗注射液上市。该药品用于成人和1岁及以上儿童患者X连锁低磷血症(XLH)的治疗,被列入“第二批临床急需境外新药名单”。
https://www.nmpa.gov.cn/yaowen/ypjgyw/20210115092032178.html
武田制药美阿沙坦钾获NMPA批准上市
1月19日,NMPA信息公示,武田制药新一代血管紧张素II受体拮抗剂(ARB)类降压药美阿沙坦钾获批上市,拟定适应症为成人原发性高血压。
https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20210121075907124.html
博雅辑因CRISPR/Cas9 基因修饰BCL11A红系增强子的自体CD34+造血干祖细胞注射液临床试验获NMPA批准
1月18日,CDE信息公示,广州辑因医疗科技有限公司CRISPR/Cas9 基因修饰BCL11A红系增强子的自体CD34+造血干祖细胞注射液临床试验申请获得NMPA批准,拟适应症为不能接受常规干细胞移植的输血依赖型β地中海贫血。这也是国内首个获国家药品监督管理局批准开展临床试验的基因编辑疗法产品和造血干细胞产品。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20#
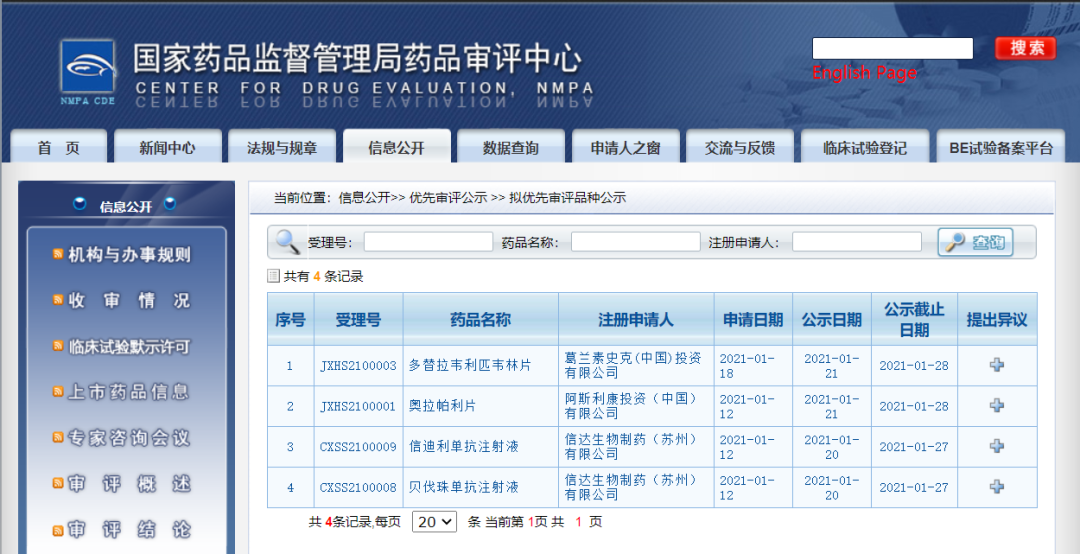
四款药物纳入拟优先审评品种
近日,CDE信息公示,四款药物纳入拟优先审评品种:1. 葛兰素史克(中国)投资有限公司的多替拉韦利匹韦林片,拟用于治疗接受稳定的抗逆转录病毒治疗方案达到病毒学抑制(HIV-1 RNA小于50拷贝/mL)至少六个月,无病毒学失败史,且对非核苷类逆转录酶抑制剂或整合酶抑制剂没有已知或疑似耐药性的成人人类免疫缺陷病毒1型(HIV-1)感染患者;
2. 阿斯利康投资(中国)有限公司的奥拉帕利片,拟用于携带BRCA1/2突变(胚系和/或体细胞系)且在既往新型激素药物治疗后出现疾病进展的转移性去势抵抗性前列腺癌成人患者的单药治疗;
3. 信达生物制药(苏州)有限公司的迪利单抗注射液与贝伐珠单抗注射液,拟定适应症为联合治疗既往未接受过系统治疗的不可切除或转移性肝细胞癌。
http://www.cde.org.cn/news.do?method=changePage&pageName=service
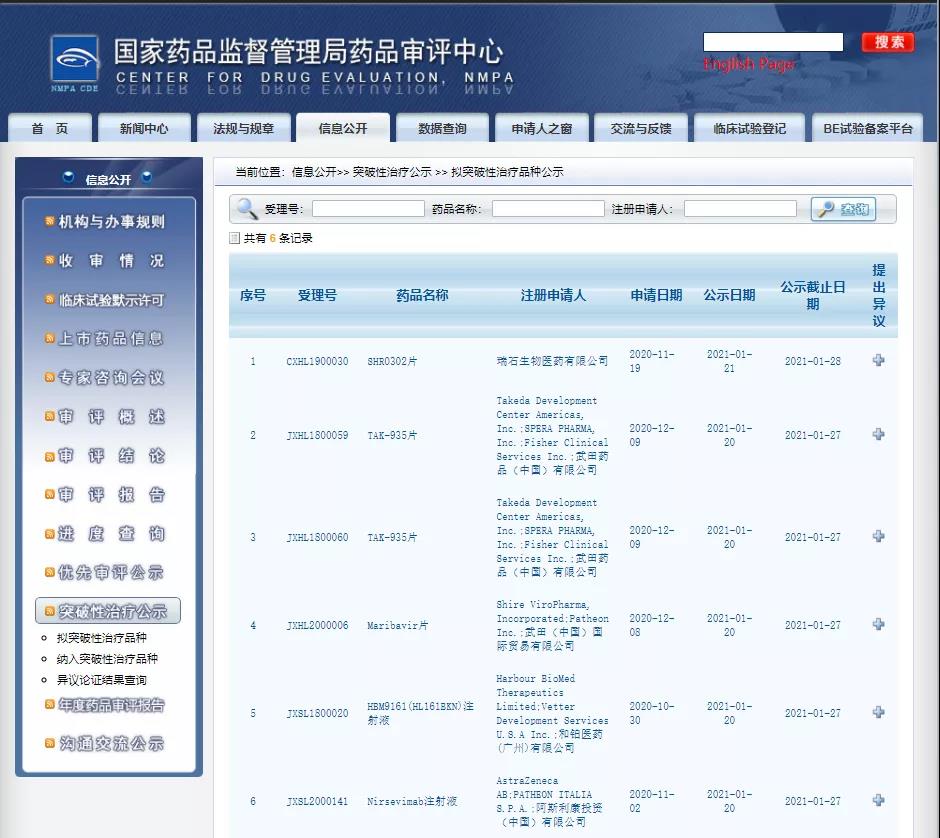
五款新药纳入拟突破性治疗品种
近日,CDE信息公示,五款新药纳入拟突破性治疗品种:1.和铂医药的HBM9161(HL161BKN)注射液,拟定适应症为全身型重症肌无力;
2.武田制药的TAK-935片,拟定适应症为Dravet综合征(婴儿严重肌阵挛性癫痫)和Lennox-Gastaut综合征(年龄依赖性癫痫性脑病的一种类型);
3.武田制药的Maribavir片,拟用于治疗移植后发生的巨细胞病毒(CMV)感染或疾病,包括对更昔洛韦、缬更昔洛韦、西多福韦和膦甲酸钠难治的和耐药的感染;
4.瑞石生物的SHR0302片,拟用于12岁及以上青少年及成人中重度特应性皮炎的治疗;
5.阿斯利康的Nirsevimab注射液,适用于预防呼吸道合胞病毒RSV下呼吸道疾病——1.在婴儿的第一个RSV感染季 2.在患有早产儿慢性肺病CLD或患有血液动力学显著改变的先天性心脏病CHD婴儿和儿童中的第一个和第二个RSV感染季。
http://www.cde.org.cn/news.do?method=changePage&pageName=service#


