第70期 / 本文由奥来恩团队原创
奥来恩编者按
9月11日,FDA发布了《以电子格式递交监管文件—使用eCTD规范的特定人用药品申请与相关文件递交》指南终稿第八版。该指南中,FDA描述了电子递交的适用范围、实施时间、eCTD规范结构以及递交接收日期。

《联邦食品、药品与化妆品法》(FD&C法)第745A(a)条适用于根据《FD&C法》第505(b)、(i)或(j)条款和《公共卫生服务法》第351(a)或(k)条款递交的文件,包括以下递交类型:
-
某些新药临床试验申请(IND)
-
新药上市许可申请(NDA)
-
仿制药上市许可申请(ANDA)
-
某些生物制品上市许可申请(BLA)
第745A(a)条款也适用于所有上述递交类型的后续递交,包括变更(Amendment)、补充(Supplement)和报告(Report)。
FDA认为递交给NDA、ANDA、BLA或IND的主文件(Master Files)属于第745A(a)条规定的要求范围。这些包括新的药品主文件(Drug Master Files,DMF)(21 CFR 314.420)、与生物制品相关的其他主文件(21 CFR 601.51),以及对先前递交的DMF或与生物制品相关的其他主文件的任何变更或年度报告。
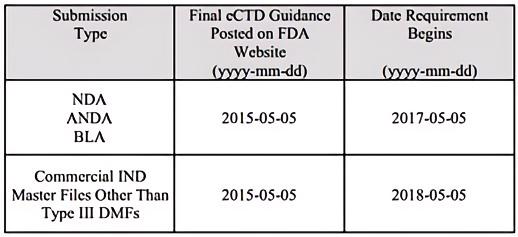
从2017年5月5日起,NDA、ANDA和BLA必须以eCTD格式递交。从2018年5月5日开始,除III类DMF外,商业IND和主文件必须以eCTD格式递交。
申请人必须使用FDA当前支持的eCTD版本进行电子递交。在首次以电子方式递交申请之前,申请人必须联系相应的中心获得预先分配的申请编号。
文件粒度(Granularity),或将递交资料分解为单独文件的级别,必须与ICH行业指南M4中的“粒度文件”一致,除非ICH M2技术规范文件中另有规定。
除了少数例外,当使用ICH 3.2.2版本eCTD递交电子文档时需要将通用技术文档(CTD)标题映射到可扩展标记语言(XML)元素。当使用ICH 4.0版本eCTD递交电子文档时需要将CTD标题映射到医疗信息交换标准(HL7)管制产品递交(RPS)版本3架构。申请人还必须遵循FDA eCTD技术规范《综合目录标题和层次结构》,以获取完整的标题和层次结构列表并将标题映射到各自法规的部分。
以eCTD格式进行递交的文件或文件夹名称只能使用字母、数字、连字符、下划线,不能使用空格和特殊字符。命名文件夹和文件时,整个路径的长度不能超过150字符。空文件夹和文件不能包含在递交的文件中。
电子递交的接收日期只有在通过了技术验证检查,以确保可以打开、处理和存档之后才能确定。递交方负责监控其接收路径以确定递交是否被拒绝。
奥来恩将会为您带来FDA及其他监管机构更多药政法规动态,欢迎大家订阅《奥来恩药政前沿》。大家对本期主题感兴趣可以在评论区提问并讨论,评论热度最高的送出精美礼品,并且抽1个转发送礼品,欢迎大家积极讨论与转发。若您有任何问题欢迎与奥来恩咨询与交流(邮箱:bd@aleonpharma.com;手机:17761872613)。


