第56期 / 本文由奥来恩药政策略团队原创
在新药研发过程中,和FDA的正式会议(Formal Meetings,简称会议)非常重要也不可避免。因为这些会议主要在新药研发的关键时刻举行,如何高效准备和成功举办FDA会议对新药研发公司特别是来自中国的初创公司是个挑战。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
奥来恩公司在2023年5月25日举办了“如何和FDA举办高效会议”的直播,收到来自中国和美国等地参会者的好评。我们现将有关信息简要在奥来恩专家解读栏目发布,希望对读者有所帮助。
1.什么是FDA会议
根据FDA的指南,正式会议是申请人按照FDA要求的程序申请的以面对面(Face-to-Face,FTF)、电话会议/视频会议 (Teleconference/Videoconference)、或仅书面答复 (Written Response Only,WRO)形式举行的会议。这个指南适用于PDUFA产品(FDA CDER(Center for Drug Evaluation and Research)与CBER(Center for Biologics Evaluation and Research)审评的产品),不包括GDUFA(仿制药)、BsUFA(生物类似药)和MDUFA(医疗器械)产品。较为传统的FDA会议类型有Type A、Type B、Type B(EoP)和Type C。FDA在今年又增加了Type D会议,并将最初由CBER建立的INTERACT会议扩展到CDER审评的产品。从2023年2月开始,FDA又开始接受由于新冠疫情中断近三年的面对面会议申请;在形式上,把视频会议以及现场(In-Person)和视频结合的会议都归类为面对面会议。
2.FDA会议的重要性
创新药研发是个漫长且充满挑战的过程。FDA对于新药研发和生产制定了许多法规和技术要求与标准。在新药研发过程中,研发公司需要获得FDA对非临床、临床、临床药理、化学和生产等许多方面的指导,能有效降低研发风险,提高新药开发效率。具体体现在以下几点:
• FDA正式会议是FDA在产品开发期间为研发公司提供指导的主要方式,并且是研发公司针对其在研产品咨询FDA并在规定时间内保证获得具体回复的唯一方式。
• 会议有助于帮助FDA监管在研产品使其遵守产品开发管理和批准上市营销后的法规。
• 在药物开发的关键阶段与FDA的会议特别有助于最大限度地减少时间和资源的浪费,从而加快药物开发和评审过程。
• 研发公司可以根据FDA提供的科学和监管建议,制定更高效和稳健的开发计划。
值得一提的是,根据我们的项目经验,许多初创研发公司的研发是外包给CRO和CDMO来完成的,因此对研发过程中具体的研发结果与过程的了解并不充分,准备FDA会议资料不仅帮助公司对研发计划做自我评估和发现可能存在的问题,并能通过FDA会议得到对研发计划和数据的认可。
3.FDA会议的现状及中国创新药公司面临的挑战
根据FDA CDER发布的PDUFA数据,FDA CDER对其监管的创新化药和生物制品在2021年有3639次正式会议,在2022年有2611次正式会议。2021年各种类型的会议分配情况见下图。
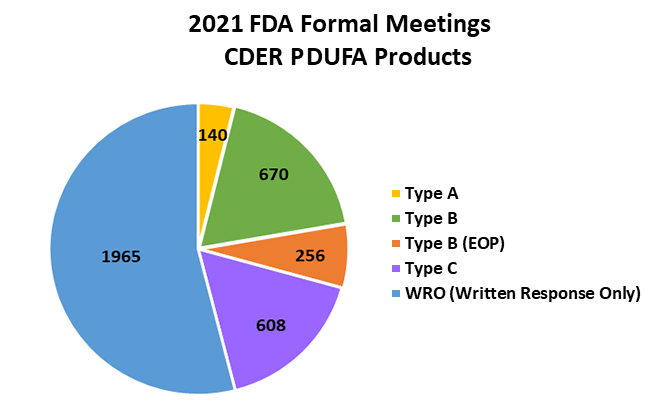
(奥来恩团队根据FDA CDER PDUFA数据制作)
预计2023年CDER对PDUFA新药研发将与申请人有四千多次FDA正式会议。这些会议的高效举行对于FDA和新药研发公司都非常重要。现实情况是许多研发公司并没有高效利用FDA会议,在准备FDA会议时还存在许多不足。以会议申请(Meeting Request)和会议资料(Meeting Package)为例,PDUFA数据表明:46%的会议申请缺乏FDA要求的内容,71%的会议申请缺乏FDA建议的内容;65%的会议资料缺乏FDA建议的内容,34%的会议资料没有提供充分的数据。由于申请人没有提供充分信息,FDA只能建议申请人去参考FDA的指南。从这些数据看出,要进行高效FDA会议,申请人需要认真对待,提高会议申请和会议资料的质量,对线上或面对面会议更要精心准备以达到会议的目的。
中国创新药公司不仅需要面对创新药公司的普遍问题,还常常要面对下面独特的挑战:
• 英语表达:对于绝大多数中国人来说,英语不是母语。在和FDA会议上用英语流利、清晰地表达对某些参会者是个挑战;• 沟通和交流方式:中美两国有许多不同,在沟通和交流方式上存在一定差异。如何在会议上有效交流,特别是在参会双方对研究结果有不同看法时如何沟通以争取最有利的结果是个挑战;
• 对FDA法规和指南的深入了解存在不足;
• 对FDA会议的重要性缺乏足够的认识;
• 团队缺乏有丰富FDA会议经验的药政事务(Regulatory Affairs)和其他职能人员;
• FDA 会议绝大多数是安排在美国东部下午时间(中国凌晨时间)举行, 也给中国参会者带来不便。
4.奥来恩如何帮助您准备和FDA的会议
奥来恩团队在准备FDA会议上具有丰富的成功经验。自从奥来恩成立以来,我们已经和FDA举行了超过130个正式会议。我们不仅准备高质量的会议申请和会议资料,在准备会议过程中,我们会利用我们建立的标准程序,根据客户的研发项目制定专有的执行计划和方案。我们会为客户的项目团队提供关于FDA会议的针对性培训并且在会议前做实际演练,帮助客户团队克服经验不足造成的紧张情绪,以最有效的方式阐述表达自己的论点,力争获得最有利的会议结果。欢迎联系我们(17761872613)。
信息来源:
[1]. FDA Guidance for Industry: Formal Meetings Between the FDA and Sponsors or Applicants of PDUFA Products (Draft). December 2017.
[2]. FDA SOPP 8101.1: Regulatory Meetings with Sponsors and Applicants for Drugs and Biological Products Version: 11 Effective Date: March 3, 2023.
[3]. FDA Website. http: www.FDA.gov.


