第45期 / 本文由奥来恩团队原创
创新药物的研究充满挑战,孤儿药的研究更是不易。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
在《奥来恩专家解读》第44期,我们重点分析了孤儿药研发在临床、临床前以及生产质量方面所面临的挑战、FDA的审评要点以及战略思考与对策。本期着重讨论药政法规策略(Regulatory Strategy),并在下一期介绍FDA支持孤儿药研发的新举措。
01.孤儿药研发与FDA审评趋势
自从1983年开始实施《孤儿药法案》(Orphan Drug Act)以来,FDA已经批准了超过600个治疗罕见病的药物。在FDA近12年(2010-2021年)批准的上市新药中,获批的孤儿药占比呈现逐年增加的趋势(见下图,CDER New Drug Approvals)。CDER在2015-2021年期间批准的323个新药中,有160个(占比49.5%)是用于治疗罕见病。而在CBER同期批准的59个新药中,有38个(占比64.4%)是用于治疗罕见病。
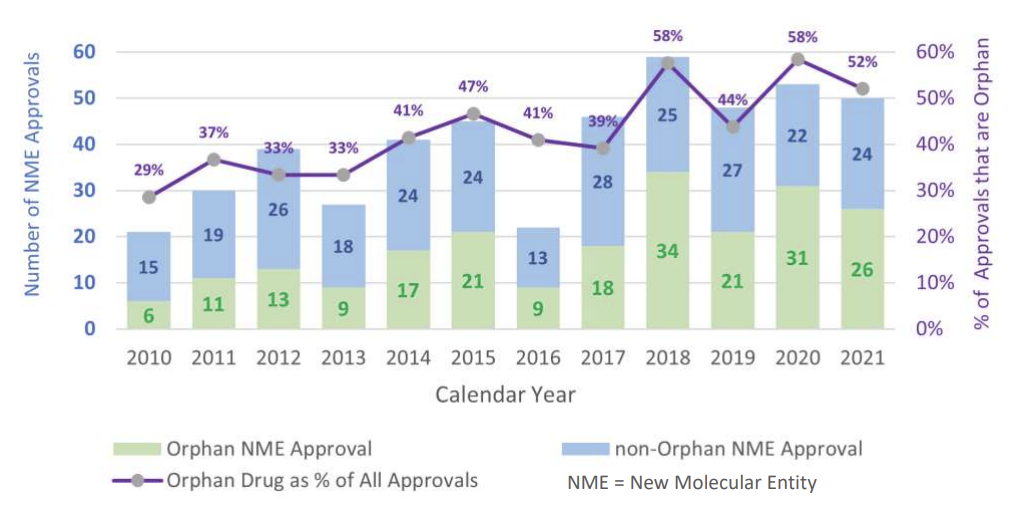
(信息来源:CDER New Drug Approvals;FDA官网 www.fda.gov)
近年来,虽然孤儿药获得FDA批准上市的数量显著增加,但在目前近7000多种罕见病中,仍然有大多数尚无获批的药物用于治疗。在美国,这些疾病影响了超过三千万人群。加快孤儿药的研发使更多的新药获批造福全球患者迫在眉睫。继上一篇《孤儿药研发面临的挑战与战略思考之—:临床、临床前与生产质量》(详见《奥来恩专家解读》第44期),本期从药政策略角度分析加快孤儿药研发的途径。
02.加快孤儿药研发的药政策略
(1)充分利用加速通道(Expedited Pathways)
大多数罕见疾病是严重或危及生命的疾病,医疗需求未得到满足。因此,治疗这些疾病的药物可能符合一项或多项加速通道的条件。FDA鼓励新药研发公司利用这些加速通道,其中包括快速通道认定、突破性疗法认定、优先审评认定、加速批准以及再生医学疗法认定(详见《奥来恩专家解读》第4、5、6、7、40期)。
根据对CDER于2015-2021年期间批准的323个新的化药和生物制品获得的加速通道的分析,孤儿药获得一种或以上FDA加快通道(At Least One Expedited Program)的比例显著高于非孤儿药(89% vs 45%);并且,孤儿药获得FDA多种加快通道(Multiple Expedited Programs)的比例同样显著高于非孤儿药(74% vs 31%)。
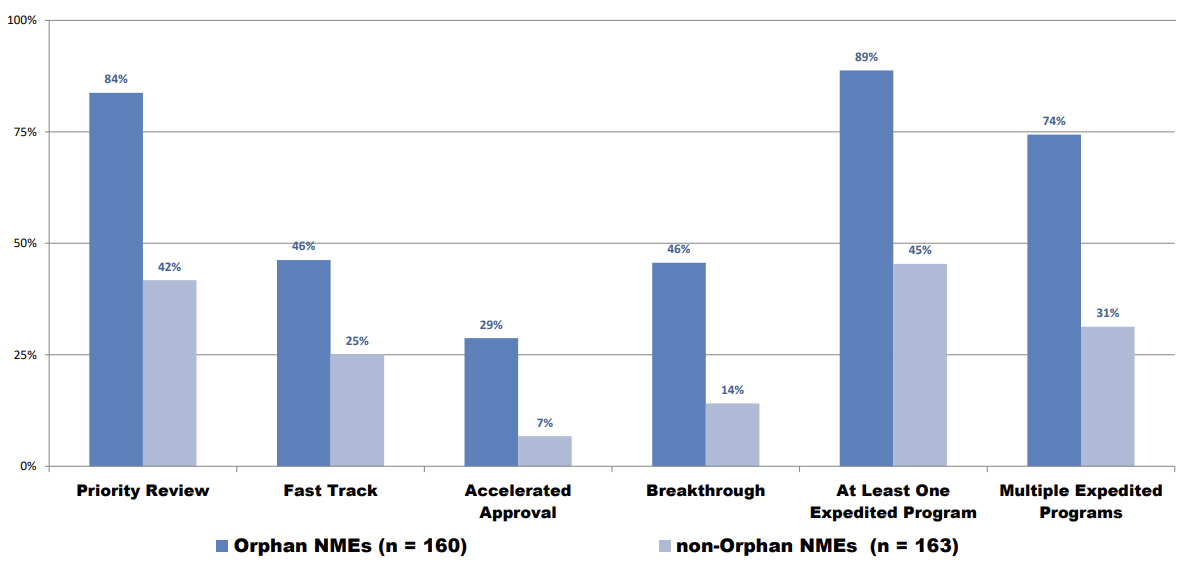
(信息来源:FDA官网www.fda.gov)
(2)充分利用与FDA的沟通
我们在《奥来恩专家解读》第37期介绍了加快创新药研发和获得上市批准的一个主要药政策略,即充分利用加快程序。另一个重要策略是充分利用与FDA的会议。FDA为新药研发公司提供了许多沟通机会(包括正式会议)。在针对罕见病的研究药物开发过程中,FDA 鼓励新药研发公司(申请人)通过与FDA有关药物审评部门进行积极沟通获得有效的建议。根据申请人的要求,FDA对IND 期间的具体事项与研发相关问题提供意见与建议。例如,有关支持研究计划的数据充分性、临床试验设计、以及临床研究计划是否可能产生满足新药上市申请(NDA/BLA)所需的数据和信息等。
此外,FDA还可以通过有关工作人员和办公室与申请人的互动提供非正式支持。例如,CDER的罕见病项目和CBER的孤儿产品开发办公室(Office of Orphan Product Development,OOPD)等。
对于寻求在药物研发早期的科学和医学沟通机会的申请人,FDA有一个关键路径创新会议(Critical Path Innovation Meetings,CPIM)的论坛,来自工业界、学术界、患者倡导团体和政府的工作与研究人员共同探讨如何提高药物开发的效率和成功率。FDA CDER工作人员经常在该论坛上就如何使用技术或方法来促进药物开发提供建议。当出现涉及CDER和CBER两个中心的交叉问题时,CBER也会参加CPIM。此外,CBER为新药研发公司提供了INTERACT会议,可以就早期药品开发至关重要的特定问题获得FDA建议。关于INTERACT会议,详见《奥来恩专家解读》第42期。
(3)制定有效的药政法规策略
创新药的研发是一项高投入、耗时且极具挑战性的任务。在新药研发过程中,熟知FDA的法规与审评要求、并充分利用有关途径来制定与规划新药研发的药政策略至关重要。我们在上面简要介绍了加速通道和有效沟通在孤儿药研发中的重要作用。我们建议新药研发公司在研发早期就制定明确的计划,以便充分利用这些程序来加快孤儿药的研发,并增加新药申请(NDA/BLA)最后获得FDA批准的成功率。奥来恩在孤儿药研发、IND/NDA/BLA申请、加速通道申请、孤儿药认定、以及与FDA会议等积累了丰富的成功经验。我们期待与创新药研发公司携手共进,为您的新药研发项目开拓更广阔的空间,使在研药物早日获批上市,造福患者。

▲ 长按扫码,分享朋友圈
信息来源:
[1]. 奥来恩专家解读 (第41期):FDA孤儿药认定趋势和2022年上半年情况深度分析。
[2]. 奥来恩专家解读(第37期):加快IND到NDA/BLA批准得药政策略-奥来恩独家分析解读。
[3]. 奥来恩专家解读(第27期):2021年FDA CDER 批准新药的分析-创新药获得FDA批准的加快通道。
[4]. 奥来恩专家解读(第3期):FDA加快创新药研发与审评的通道-2020年CDER批准的新药分析。
[5]. 奥来恩专家解读(第4期):FDA突破性治疗认定-新药研发与审评的加速通道系列之一。
[6]. 奥来恩专家解读(第5期):FDA快速通道认定-新药研发与审评的加速通道系列之二。
[7]. 奥来恩专家解读(第6期):FDA优先审评认定-新药研发与审评的加速通道系列之三。
[8]. 奥来恩专家解读(第7期):FDA加速批准-新药研发与审评的加速通道系列之四。
[9]. 奥来恩专家解读(第8期):FDA孤儿药认定-新药研发与审评的加速通道系列之五。
[10]. FDA Guidance for Industry: Rare Diseases: Common Issues in Drug Development. January 2019, Revision 1.
[11]. CDER’s Perspective on Working Together with Our Rare Disease Partners within CDER and across FDA, Kerry Jo Lee, M.D., REdI Annual Conference 2022.


