本文由奥来恩团队原创
本期看点:Moderna和Pfizer-BioNTech二价COVID-19疫苗获FDA授权;首个治疗酸性鞘磷脂酶缺乏症的药物获FDA批准;首个治疗慢性移植物抗宿主病儿童患者的药物获FDA批准;多款药物获药监机构特殊审评认定。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
COVID-19
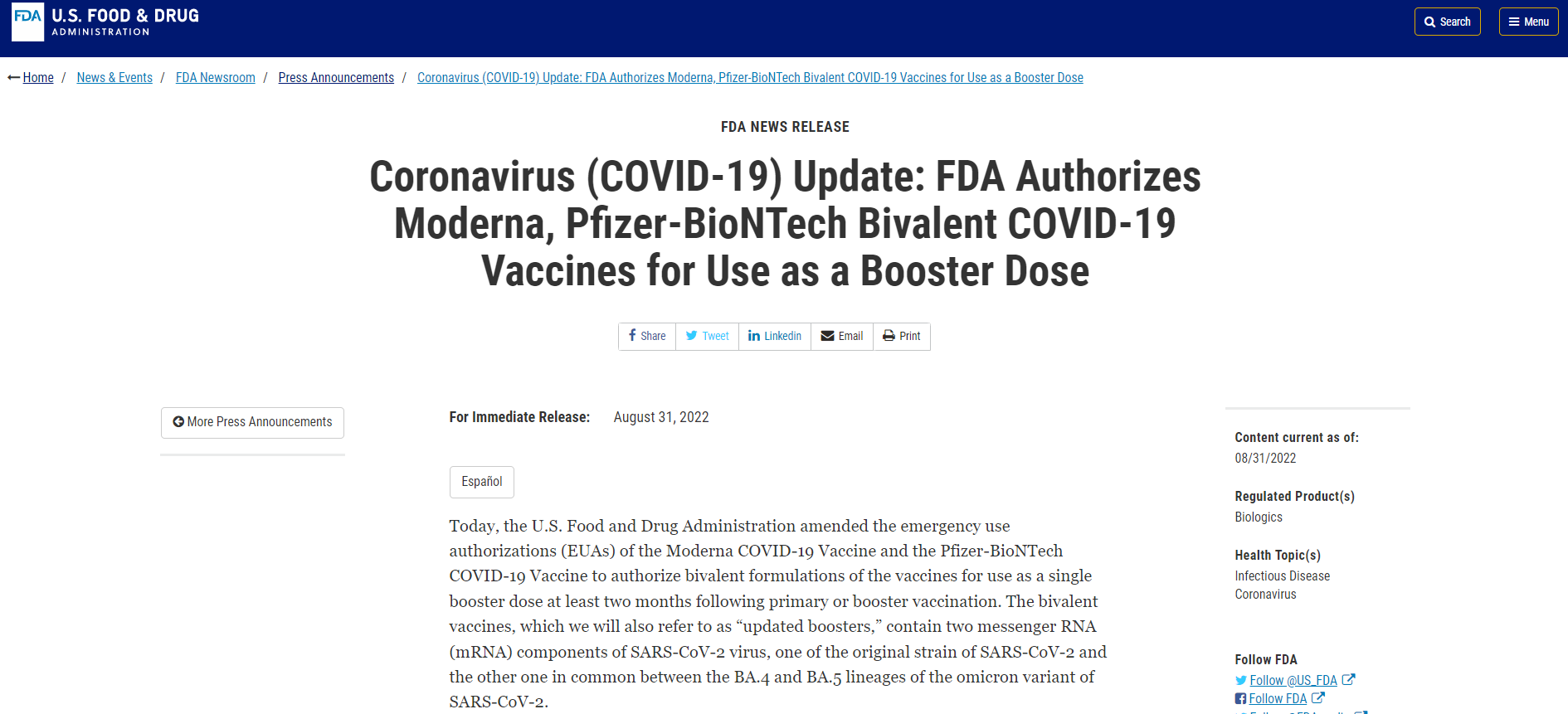
【FDA】Moderna和Pfizer-BioNTech二价COVID-19疫苗获FDA授权
近日,FDA修正了Moderna COVID-19疫苗和Pfizer-BioNTech COVID-19疫苗的紧急使用授权(Emergency Use Authorization,EUA),允许它们的二价制剂作为单次加强剂量在初次接种疫苗或接种加强针至少两个月之后使用。
来源:FDA官网
新药批准
【FDA】首个治疗酸性鞘磷脂酶缺乏症的药物获FDA批准
近日,Genzyme的Xenpozyme(olipudase alfa)获FDA批准,以静脉输液的方式治疗酸性鞘磷脂酶缺乏症(ASMD)儿童和成人患者。ASMD是一种罕见的基因疾病,会造成患者过早地死亡。

来源:FDA官网
【FDA】首个治疗慢性移植物抗宿主病儿童患者的药物获FDA批准
近日,The JanssenPharmaceutical Companies of Johnson & Johnson的Imbruvica®(ibrutinib)获FDA批准,用于治疗一岁及以上儿童患者的慢性移植物抗宿主病(cGVHD),这些患者此前接受一次或多次系统治疗失败。

来源:Johnson & Johnson官网
特殊审评
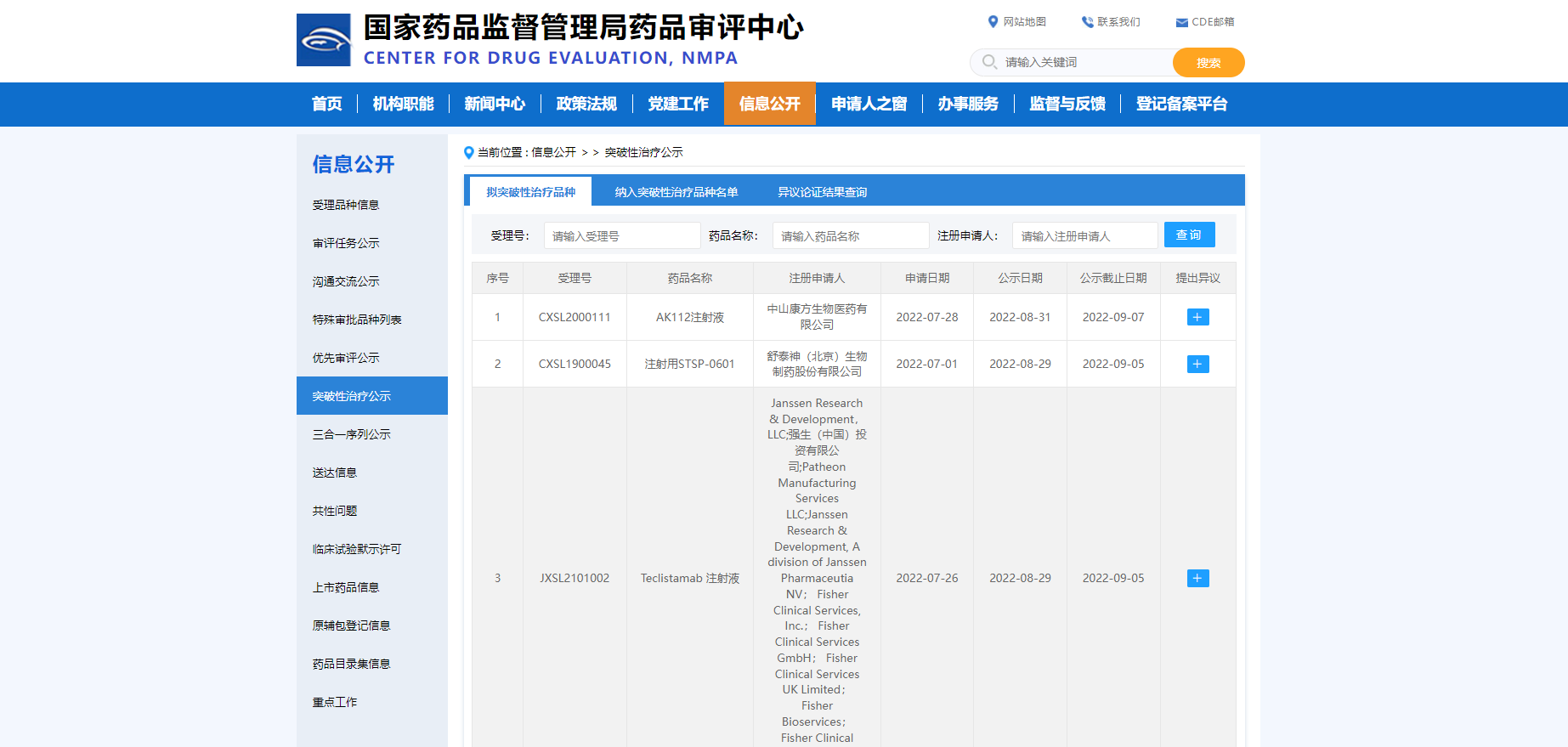
【NMPA】三款药物纳入拟突破性治疗品种
近日,三款药物纳入拟突破性治疗品种:
1. Janssen Research & Development, LLC的Teclistamab注射液,拟用于治疗既往至少接受过3线治疗的复发或难治性多发性骨髓瘤成人患者,其既往治疗包括一种蛋白酶体抑制剂(PI)、一种免疫调节剂(IMiD)和一种抗CD38单克隆抗体;
2. 舒泰神(北京)生物制药股份有限公司的注射用STSP-0601,拟用于伴抑制物血友病A或B患者出血按需治疗;
3. 中山康方生物医药有限公司的AK112注射液,拟用于一线治疗PD-L1表达阳性(TPS≥1%)的局部晚期或转移性非小细胞肺癌。
来源:CDE官网
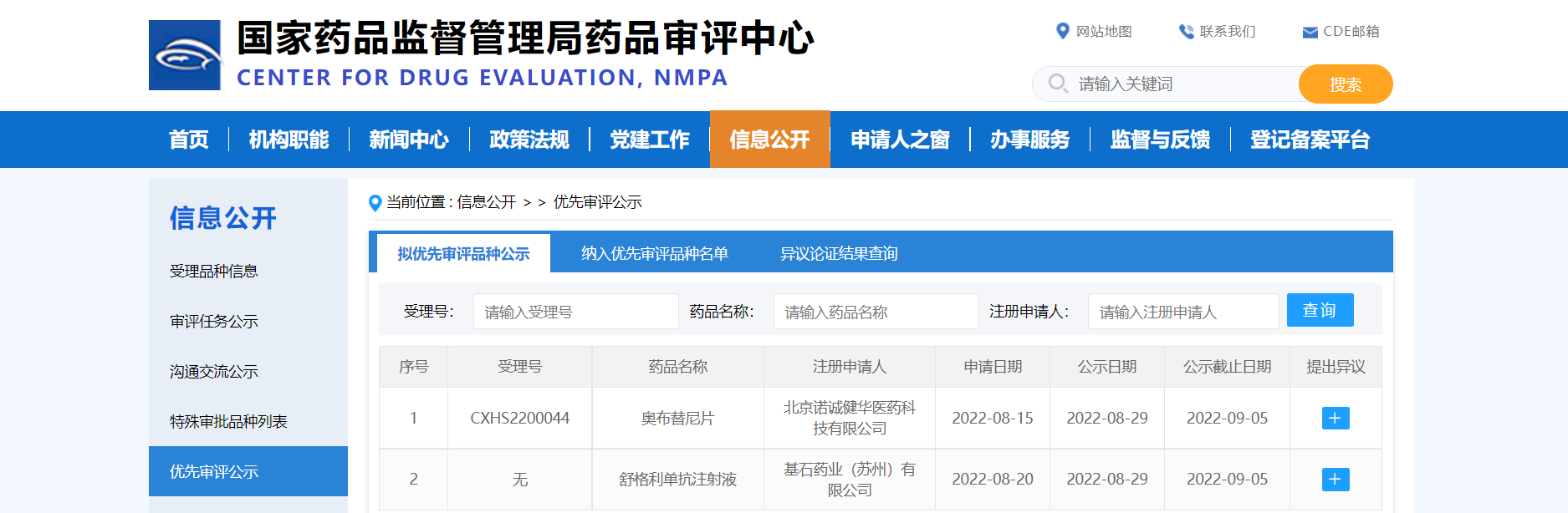
【NMPA】两款药物纳入拟优先审评品种
近日,两款药物纳入拟优先审评品种:
1. 基石药业(苏州)有限公司的舒格利单抗注射液,拟用于单药治疗复发或难治性结外NK/T细胞淋巴瘤(R/R ENKTL);
2. 北京诺诚健华医药科技有限公司的奥布替尼片,拟用于治疗既往至少接受过一种治疗的成人边缘区淋巴瘤(MZL)患者。
来源:CDE官网


