本文由奥来恩团队原创
本期看点:NovavaxCOVID-19疫苗获FDA紧急使用授权;CDE发布《急性髓细胞白血病新药临床研发技术指导原则(征求意见稿)》;多款药物获药监机构特殊审评认定。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
重要会议
FDA,2022.07.28,Conversations on Cancer: Clinical Trial Site Selection: Fact vsFiction
COVID-19
【FDA】Novavax COVID-19疫苗获FDA紧急使用授权
近日,NovavaxCOVID-19疫苗获FDA紧急使用授权(Emergency Use Authorizatin,EUA),用作18岁及以上成人COVID-19的预防。

来源:FDA官网
法规政策
【NMPA】CDE发布《急性髓细胞白血病新药临床研发技术指导原则(征求意见稿)》
急性髓细胞白血病(Acutemyeloid leukemia,AML)是一种起源于髓系造血干/祖细胞的血液系统恶性疾病,多发于老年患者,但在儿童甚至新生儿中也不罕见。AML进展快、异质性强的特征,以及个性化精准治疗的临床要求,给新药临床研发带来了多重挑战。为进一步明确技术标准,使AML适应症的新药研发人员更准确地把握疾病特征,并推动以患者为核心的新药研发理念,在临床试验设计和执行过程中更深入地关注和了解患者的需求,CDE发布了《急性髓细胞白血病新药临床研发技术指导原则(征求意见稿)》。
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/news/viewInfoCommon/1ed55338f26c458fd6dd0deb0a3df45a
特殊审评
【FDA】Sumitomo Pharma的DSP-0390获FDA孤儿药认定
近日,Sumitomo Pharma Oncology, Inc.的DSP-0390获FDA孤儿药认定(OrphanDrug Designation, ODD),用于治疗脑癌。DSP-0390是一种依莫帕米(emopamil)结合蛋白(EBP)抑制剂。

来源:Sumitomo Pharma官网
【FDA】Wugen的WU-CART-007获FDA快速通道认定
近日,Wugen, Inc.的WU-CART-007获FDA快速通道认定(FastTrack Designation,FTD),用于治疗复发性或难治性(R/R)T细胞急性淋巴细胞白血病(T-ALL)/淋巴细胞淋巴瘤(LBL)。
来源:Wugen官网
【FDA】Karyopharm的Eltanexor获FDA快速通道认定
近日,KaryopharmTherapeutics Inc.的Eltanexor获FDA快速通道认定,用于单药治疗复发性或难治性中危、高危或极高危骨髓增生异常综合征(MDS)患者。

来源:Karyopharm官网
【FDA】Olema Oncology的OP-1250获FDA快速通道认定
近日,OlemaPharmaceuticals, Inc.的OP-1250获FDA快速通道认定,用于治疗雌激素受体(ER)阳性(ER+)、人表皮生长因子受体2阴性(HER2-)转移性乳腺癌患者,这些患者在接受一种或多种内分泌治疗后进展,其中至少一种与细胞周期蛋白依赖性激酶(CDK)4/6抑制剂联合使用。

来源:Olema Oncology官网
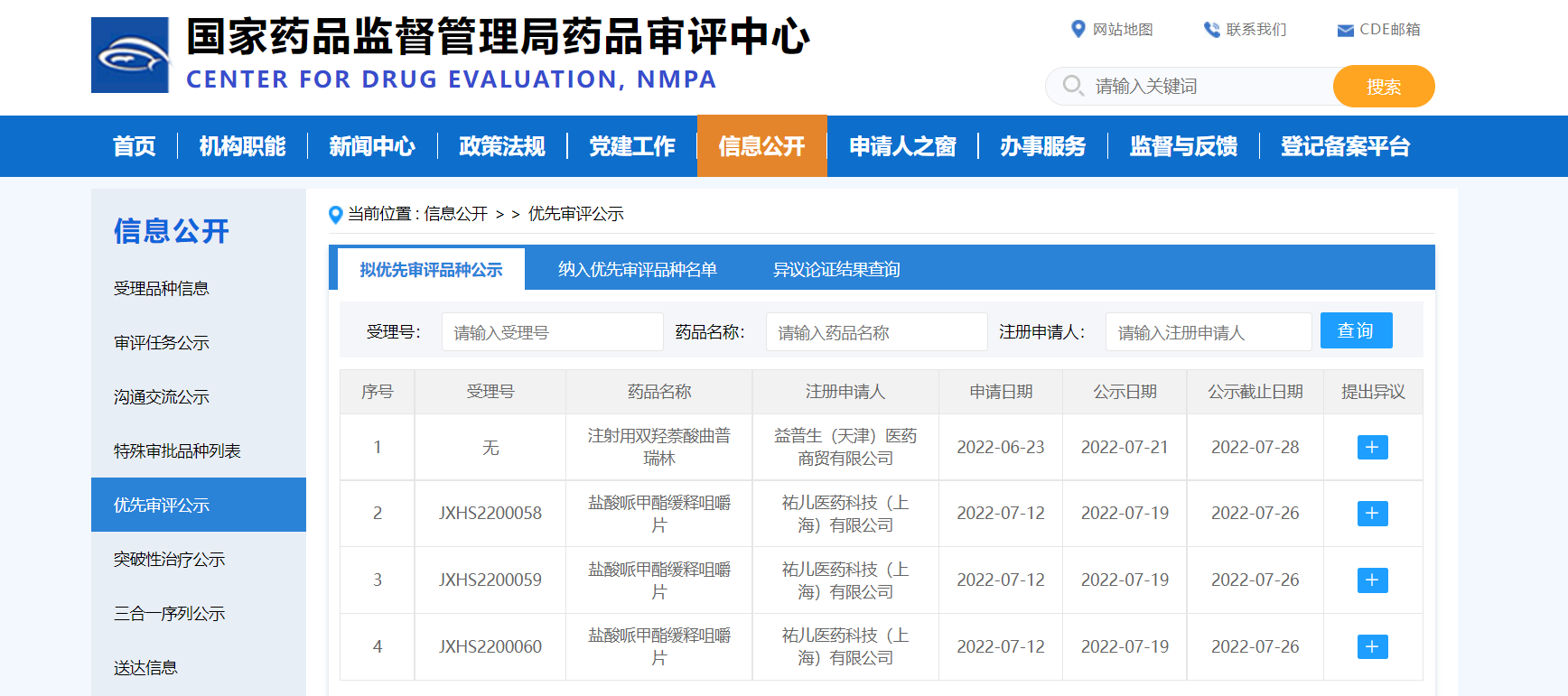
【NMPA】两款药物纳入拟优先审评品种
近日,两款药物纳入拟优先审评品种:
1. 祐儿医药科技(上海)有限公司的盐酸哌甲酯缓释咀嚼片(规格:20 mg,30 mg,40 mg),拟用于治疗注意缺陷多动障碍(ADHD);
2. 益普生(天津)医药商贸有限公司的注射用双羟萘酸曲普瑞林,拟用于治疗局部晚期和转移性前列腺癌、子宫内膜异位症(I至IV期)和中枢性性早熟(8岁前的女孩和10岁前的男孩)。
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731


