本文由奥来恩团队原创
本期看点:CDE发布《药物临床试验期间方案变更技术指导原则(试行)》;百时美施贵宝的CART产品BREYANZI®新适应症获FDA批准;多个产品获药监机构特殊审评认定。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
法规政策
【NMPA】CDE发布《药物临床试验期间方案变更技术指导原则(试行)》
近日,为指导药物临床试验申办者规范开展临床试验期间方案变更相关工作,CDE正式发布了《药物临床试验期间方案变更技术指导原则(试行)》。

来源:CDE官网
新药审批
【FDA】百时美施贵宝的CAR T产品BREYANZI®新适应症获FDA批准
近日,百时美施贵宝的Breyanzi®(lisocabtagene maraleucel)获FDA批准,用于治疗大B细胞淋巴瘤(LBCL)成人患者,包括未另行指定的弥漫性大 B 细胞淋巴瘤(DLBCL)(包括由惰性淋巴瘤引起的DLBCL)、高级别B细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤和滤泡性淋巴瘤3B级。Breyanzi®是一种CD19导向的嵌合抗原受体(CAR)T细胞疗法。

来源:百时美施贵宝官网
特殊审评
【FDA】Phanes Therapeutics的PT886获FDA孤儿药认定
近日,PhanesTherapeutics的PT886获FDA孤儿药认定(Orphan Drug Designation,ODD),用于治疗胰腺癌。PT886是一种靶向claudin 18.2(CLDN 18.2)和分化簇47(CD47)的创新型双特异性抗体,目前被开发用于治疗胰腺癌以及胃癌和胃食管癌。
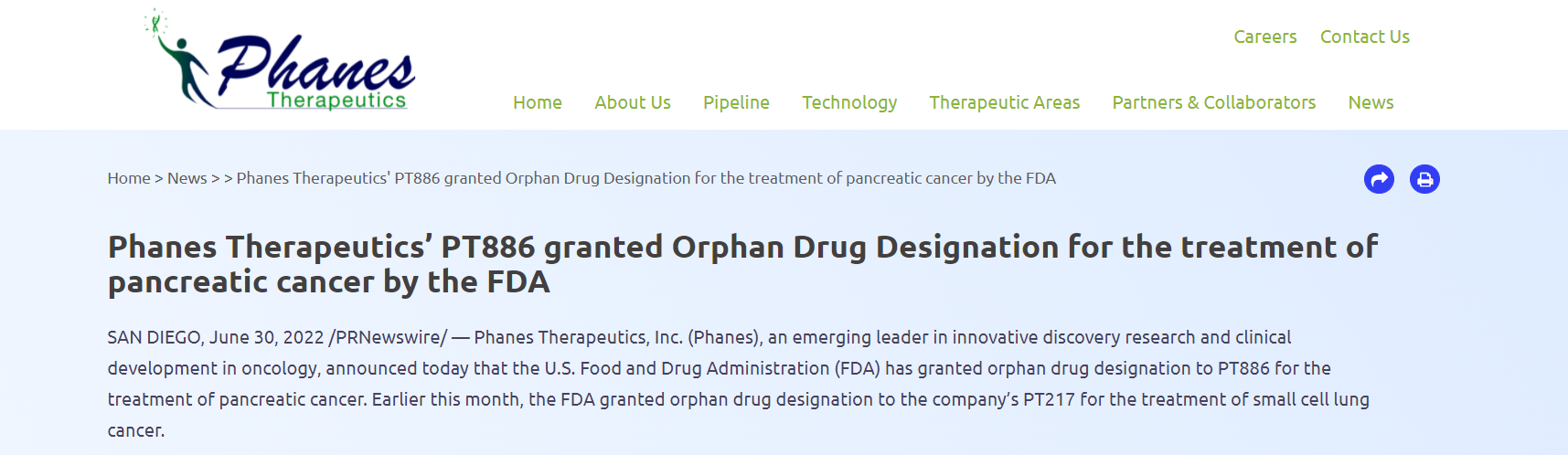
来源:Phanes Therapeutics官网
【FDA】Johnson & Johnson的TALQUETAMAB获FDA突破性治疗认定
近日,Johnson& Johnson子公司JanssenPharmaceutical Companies的Talquetamab获FDA突破性治疗认定(BreakthroughTherapy,BTD),用于治疗复发或难治性多发性骨髓瘤患者,这些患者此前曾接受过至少四种治疗,包括一种蛋白酶体抑制剂、一种免疫调节剂和一种抗CD-38抗体。

来源:Johnson & Johnson官网
【FDA】罗氏LUNSUMIO®获FDA优先审评认定
近日,罗氏的Lunsumio®(mosunetuzumab)获FDA优先审评认定(Priority Review),用于治疗复发性或难治性(R/R)滤泡性淋巴瘤(FL)成人患者,这些患者此前接受过至少两种系统性治疗。Lunsumio®此前曾获得FDA孤儿药和突破性治疗认定。

来源:罗氏官网
【NMPA】三款药物纳入拟突破性治疗品种
近日,三款药物纳入拟突破性治疗品种:
1. 诺华(中国)生物医学研究有限公司的OAV101注射液,拟用于脊髓性肌萎缩症(SMA)患者的治疗;
2. 上海恒润达生生物科技有限公司的抗人BCMA T细胞注射液,拟用于治疗复发/难治性多发性骨髓瘤;
3. 武汉纽福斯生物科技有限公司的NR082眼用注射液,拟用于治疗Leber遗传性视神经病变(G11778A突变。
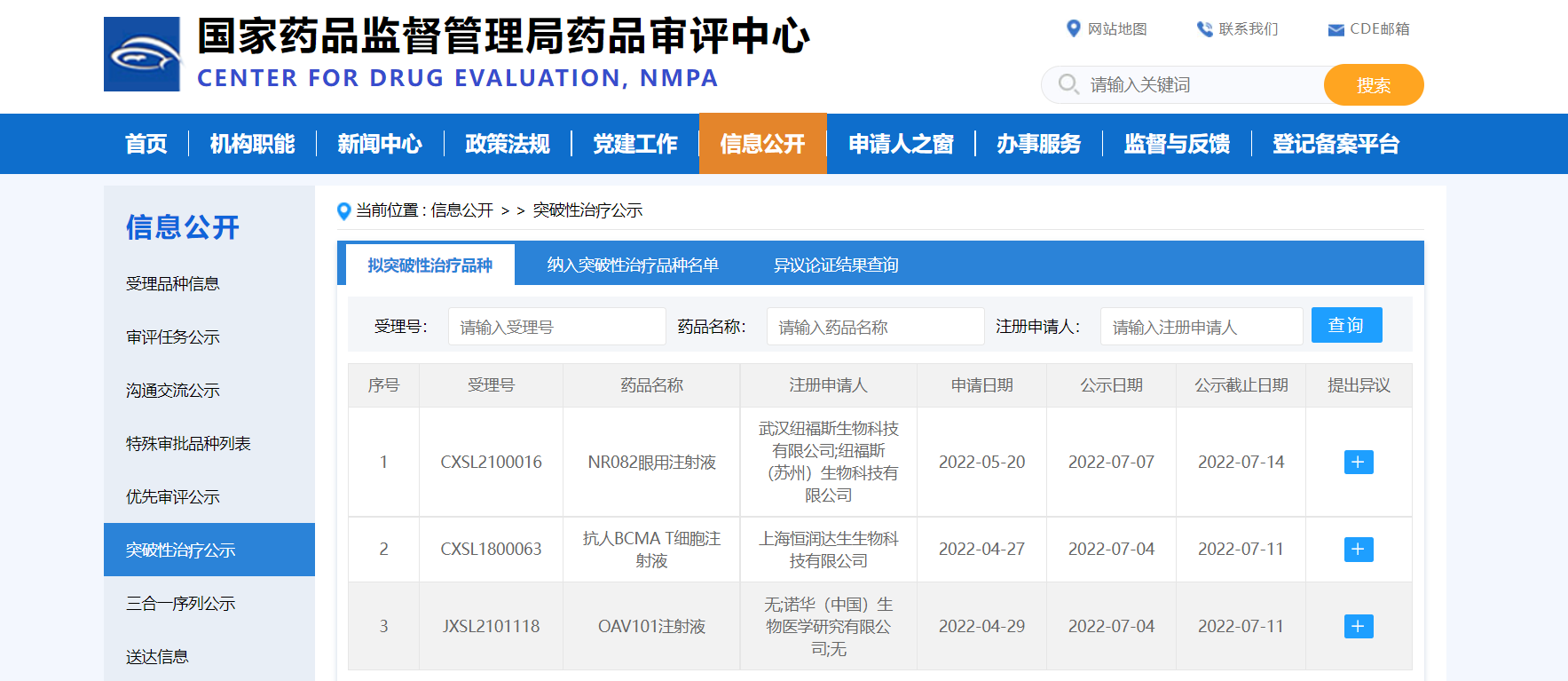
来源:CDE官网
【NMPA】苏庇医药安纳白介素注射液(预充式)纳入拟优先审评品种
近日,苏庇医药安纳白介素注射液(预充式)纳入拟优先审评品种,拟用于治疗成人、青少年、儿童和8 个月及以上婴幼儿(体重10kg 及以上)患者的自身炎症性周期性发热综合征(治疗家族性地中海热(FMF))。
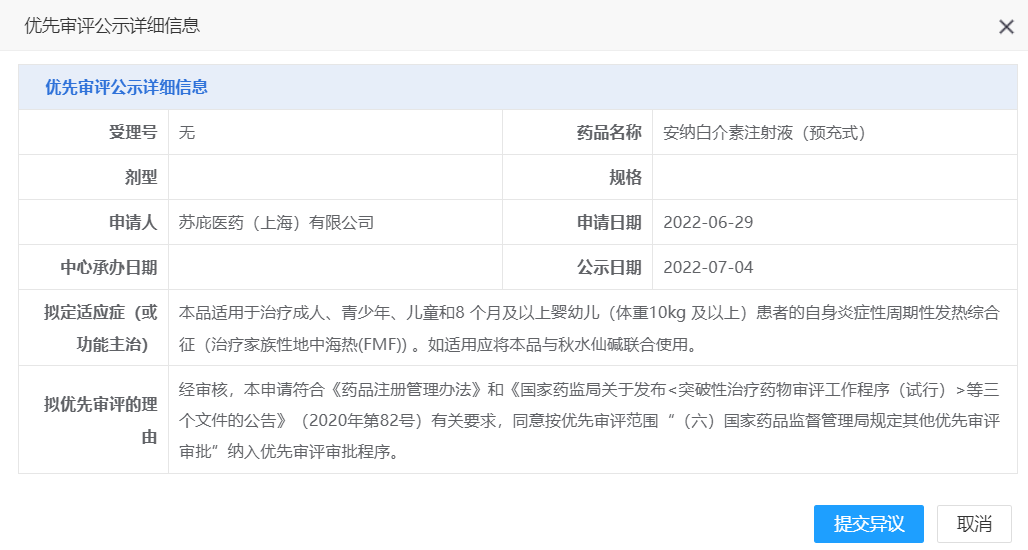
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731


