第52期 / 本文由奥来恩团队原创
本期看点:Moderna和Pfizer-BioNTech COVID-19疫苗扩大EUA人群;Alnylam的RNAi药物AMVUTTRA™获FDA批准;信达生物信迪利单抗注射液新适应症获NMPA批准;多款药物获药监机构特殊审评认定。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
近期会议
FDA,2022.06.29-06.30,Cellular, Tissue, and Gene Therapies Advisory Committee June 29-30,2022 Meeting Announcement
COVID-19
【FDA】Moderna和Pfizer-BioNTech COVID-19疫苗获FDA批准扩大紧急使用授权人群
近日,Moderna和Pfizer-BioNTech COVID-19疫苗获FDA批准扩大紧急使用授权(Emergency Use Authorization,EUA)人群。
对于Moderna疫苗,FDA扩大紧急使用授权包括年龄6个月至17岁的群体。该疫苗此前已获得授权在18岁及以上成人患者中使用。
对于Pfizer-BioNTech疫苗,FDA扩大紧急使用授权包括年龄6个月至4岁的群体。该疫苗此前已获得授权在5岁及以上人群中使用。

来源:FDA官网
新药审批
【FDA】Alnylam的RNAi药物AMVUTTRA™获FDA批准
近日,AlnylamPharmaceuticals, Inc.的RNAi药物AMVUTTRA™(vutrisiran)获FDA批准,用于治疗遗传性转甲状腺素蛋白介导(hATTR)的淀粉样变性的多发性神经病。AMVUTTRA™通过皮下注射给药,每三个月一次。

来源:Alnylam官网
【NMPA】信达生物信迪利单抗注射液新适应症获NMPA批准
近日,信达生物制药集团的PD-1抑制剂达伯舒®(信迪利单抗注射液)获NMPA批准,联合紫杉醇和顺铂或氟尿嘧啶和顺铂用于不可切除的局部晚期、复发或转移性食管鳞癌的一线治疗。

来源:信达生物官网
特殊审评
【FDA】Nammi Therapeutics的QXL138AM获FDA孤儿药认定
近日,NammiTherapeutics, Inc.的QXL138AM获FDA孤儿药认定(OrphanDrug Designation,ODD),用于治疗胰腺癌。QXL138AM治疗多发性骨髓瘤此前也曾获得ODD。

来源:CISION官网
【FDA】Kazia Therapeutics的paxalisib获FDA孤儿药认定
近日,KaziaTherapeutics Limited的Paxalisib获FDA孤儿药认定(ODD),用于治疗非典型畸胎样/横纹肌样瘤(atypical teratiod/rhabdoidtumor,AT/RT)。AT/RT是一种罕见且具有高度侵袭性的儿童脑癌。

来源:Kazia官网
【FDA】Phanes Therapeutics的PT217获FDA孤儿药认定
近日,Phanes Therapeutics,Inc.的PT217获FDA孤儿药认定(ODD),用于治疗小细胞肺癌(smallcell lung cancer,SCLC)。PT217是一种靶向δ样配体3(Delta-likeligand 3,DLL3)和分化簇47(CD47)的原创性双特异性抗体,目前被开发用于小细胞肺癌和其他神经内分泌癌患者的治疗。

来源:Phanes官网
【FDA】Kintara Therapeutics的VAL-083获FDA快速通道认定
近日,KintaraTherapeutics, Inc.的VAL-083获FDA快速通道认定(FastTrack Designation,FTD),用于治疗新诊断的未甲基化胶质母细胞瘤(GBM)。VAL-083是一种原创性小分子化学药物,对一系列肿瘤都表现出临床活性,包括中枢神经系统、卵巢和其他实体瘤。
来源:Kintara官网
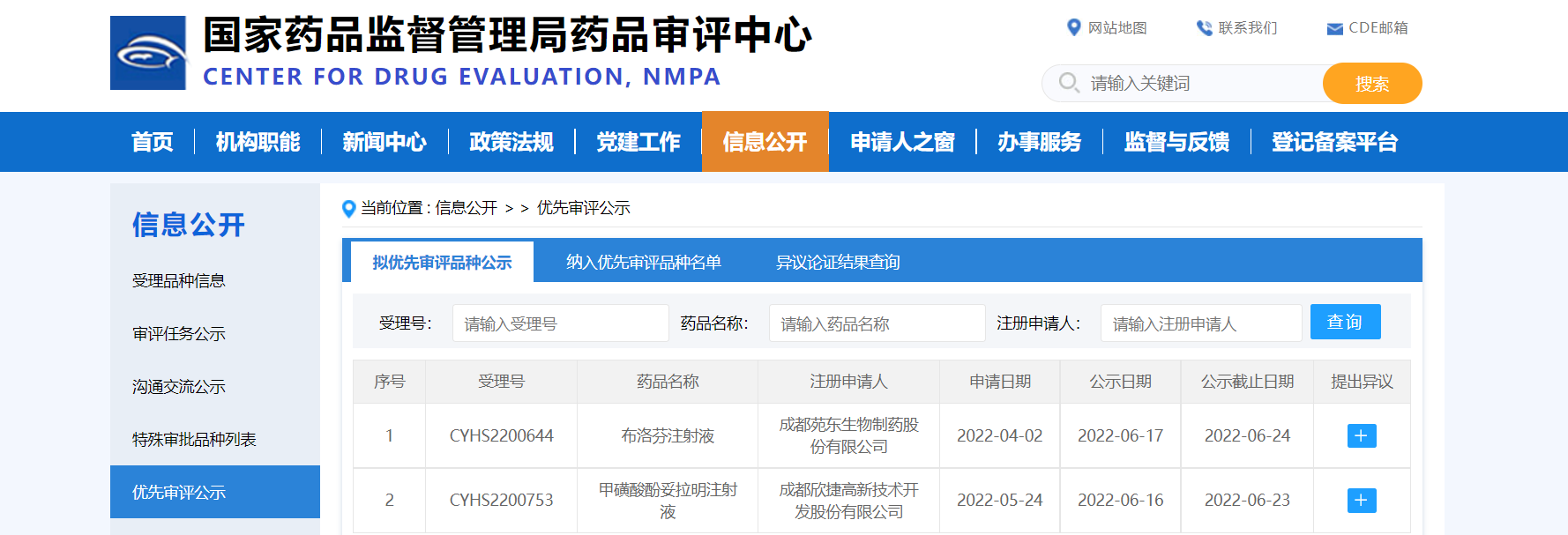
【NMPA】两款药物纳入拟优先审评品种
近日,两款药物纳入拟优先审评品种:
1. 成都欣捷高新技术开发股份有限公司的甲磺酸酚妥拉明注射液,拟用于控制嗜铬细胞瘤患者在手术治疗前和手术过程中的阵发性高血压以及预防去甲肾上腺素外溢引起的皮肤坏死和腐烂;
2. 成都苑东生物制药股份有限公司的布洛芬注射液,拟用于治疗胎龄小于34周的早产新生儿的有血流动力学意义的动脉导管未闭。
来源:CDE官网


