本期看点:CDE发布四篇关于药学研究与评价技术指导原则;CDE发布《中国新药注册临床试验进展年度报告(2021年)》;两种基于OPDIVO®的食管鳞状细胞癌治疗方案获FDA批准;诺华CAR-T疗法KYMRIAH®新适应症获FDA加速批准;多款药物获药监机构特殊审评认定。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
法规政策
【NMPA】CDE发布四篇关于药学的研究与评价技术指导原则
近日,CDE正式发布了四篇关于药学的研究与评价技术指导原则,分别是《特异性人免疫球蛋白药学研究与评价技术指导原则》、《体外基因修饰系统药学研究与评价技术指导原则(试行)》、《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》以及《体内基因治疗产品药学研究与评价技术指导原则(试行)》。

来源:CDE官网
【NMPA】CDE发布《中国新药注册临床试验进展年度报告(2021年)》
近日,CDE根据药物临床试验登记与信息公示平台的新药临床试验登记信息,对2021年中国新药注册临床试验现状进行了全面汇总和分析,发布了《中国新药注册临床试验进展年度报告(2021年)》。
本次年度报告主要根据2021年度登记的药物临床试验信息,从药物类型、品种及靶点特征、适应症、申办者类型、注册分类、试验分类、试验分期、特殊人群试验、临床试验组长单位、启动耗时和完成情况等角度对临床试验的总体趋势变化、主要特点、突出问题等进行汇总分析,同时对比近三年临床试验登记数据,对近年来的趋势特征进行总结分析。

来源:CDE官网
新药审批
【FDA】两种基于OPDIVO®的食管鳞状细胞癌治疗方案获FDA批准
近日,百时美施贵宝的Opdivo®(nivolumab)(静脉注射)与氟嘧啶类和铂类化疗联用以及Opdivo®与Yervoy®(ipilimumab)联用获FDA批准用于治疗手术不可切除的晚期或转移性食管鳞状细胞癌(ESCC)成人患者(不考虑PD-L1状态)。

来源:百时美施贵宝官网
【FDA】诺华CAR-T疗法Kymriah®新适应症获FDA加速批准
近日,诺华Kymriah®(tisagenlecleucel)新适应症获FDA加速批准(Accelerated Approval),用于治疗复发性或难治性滤泡性淋巴瘤(r/r FL)成人患者,这些患者先前接受过两种及以上系统治疗。

来源:诺华官网
特殊审评
【FDA】Elevation Oncology的Seribantumab获FDA快速通道认定
近日,ElevationOncology, Inc.的Seribantumab获FDA快速通道认定(Fast Track Designation,FTD),用作存在NRG1基因融合的晚期实体瘤患者的泛肿瘤疾病治疗方案。

来源:Elevation Oncology官网
【FDA】PDS Biotechnology的PDS0101与KEYTRUDA®联用获FDA快速通道认定
近日,PDS BiotechnologyCorporation的PDS0101与KEYTRUDA®(pembrolizumab)联用获FDA快速通道认定(FTD),用于治疗复发性或转移性HPV16阳性头颈癌。
来源:PDS Biotechnology官网
【FDA】Y-mAbs的OMBLASTYS®获FDA优先审评认定
近日,Y-mAbsTherapeutics, Inc.的OMBLASTYS®(omburtamab)生物制品许可申请(BLA)获FDA优先审评认定(Priority Review),用于治疗神经母细胞瘤儿科患者出现的中枢神经系统或软脑膜转移。

来源:Y-mAbs官网
【NMPA】四款药物纳入拟突破性治疗品种
近日,四款药物纳入拟突破性治疗品种:
1. 再鼎医药(上海)有限公司的Repotrectinib胶囊,拟用于治疗既往接受过一线ROS1 TKI治疗失败且未接受过化疗或免疫治疗以及既往接受过一线ROS1 TKI以及一线含铂化疗治疗失败的ROS1阳性非小细胞肺癌;
2. 益方生物科技(上海)有限公司的D-1553片,拟用于治疗既往接受抗PD-(L)1治疗和/或化疗后出现疾病进展,并经检测确认存在KRAS G12C突变且无其它驱动基因突变或重排(如EGFR,ALK和ROS1)的局部晚期或转移性非小细胞肺癌患者;
3. 辉瑞投资有限公司的Ritlecitinib胶囊,拟用于治疗成人中度至重度活动性溃疡性结肠炎(UC);
4. 康诺亚生物医药科技(成都)有限公司的CM310重组人源化单克隆抗体注射液,拟用于治疗中重度特应性皮炎。
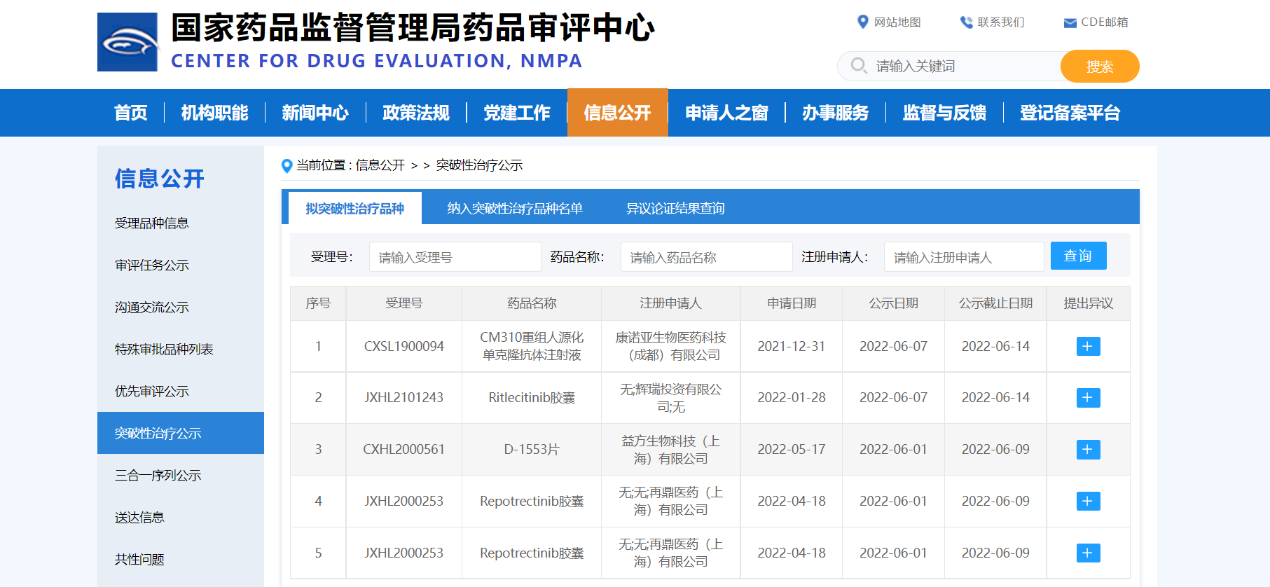
来源:CDE官网
【NMPA】驯鹿生物伊基仑赛注射液纳入拟优先审评品种
近日,南京驯鹿生物医药有限公司的伊基仑赛注射液纳入拟优先审评品种,拟用于治疗既往接受三线或以上系统性治疗后复发或难治性多发性骨髓瘤成人患者。

来源:CDE官网


