第49期 / 本文由奥来恩团队原创
本期看点:首个用于治疗COVID-19的免疫调节药物获FDA批准;ENHERTU治疗乳腺癌获FDA常规批准;IDEAYABiosciences的DAROVASERTIB和AgastiyaBiotech的AB001获FDA孤儿药认定;TurningPoint Therapeutics的REPOTRECTINIB获FDA突破性治疗认定;Aptose的HM43239获FDA快速通道认定;拜耳DAROLUTAMIDE补充新药申请和阿斯利康IMFINZI补充生物制品许可申请获FDA优先审评认定;四款药物获NMPA批准纳入拟优先审评品种。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
COVID-19
【FDA】礼来OLUMIANT新适应症获批
近日,Eli Lilly and Company的Olumiant(baricitinib)新适应症获得FDA批准,用于需要补充氧气、无创或有创机械通气或体外膜肺氧合(ECMO)的住院成人患者COVID-19的治疗。Olumiant是首个获得FDA批准用于治疗COVID-19的免疫调节药物。
此前,Olumiant曾获FDA紧急使用授权(Emergency Use Authorization,EUA)用于需要补充氧气、无创或有创机械通气或体外膜肺氧合(ECMO)的住院成人和两岁或以上儿童患者COVID-19的治疗,目前对两岁或以上儿童患者群体的治疗仍保留为紧急使用授权状态。

来源:FDA官网
点击查看:
https://www.fda.gov/news-events/press-announcements/fda-roundup-may-10-2022
新药审批
近日,Daiichi Sankyo, Inc.的Enhertu(fam-trastuzumabderuxtecan-nxki)获FDA常规批准,用于治疗不可切除或转移性HER2阳性的成人乳腺癌患者,这些患者此前在转移性治疗或在新辅助或辅助治疗接受过基于抗HER2的治疗方案,并且在治疗期间或完成后6个月内出现疾病复发。
Enhertu治疗乳腺癌曾在2019年12月获得FDA加速批准,此次在一系列验证性试验支持下获得了FDA常规批准。该申请曾获得FDA突破性治疗认定以及优先审评认定。

来源:FDA官网
特殊审评
【FDA】IDEAYA Biosciences的DAROVASERTIB获FDA孤儿药认定
近日,IDEAYA Biosciences, Inc.的Darovasertib获FDA孤儿药认定(Orphan Drug Designation,ODD),用于治疗葡萄膜黑色素瘤(Uveal Melanoma)。Darovasertib是一种蛋白激酶C(PKC)抑制剂。

![]()
来源:IDEAYA官网
【FDA】Agastiya Biotech的AB001获FDA孤儿药认定
近日,Agastiya Biotech的AB001获FDA孤儿药认定,用于治疗胰腺癌和急性髓细胞白血病(AML)。AB001是一种小分子PD-L1检查点抑制剂,它还靶向肿瘤微环境中异常的细胞内信号通路,例如Wnt/β-连环蛋白、PI3K和RAS。

来源:CISION官网
【FDA】Turning Point Therapeutics的REPOTRECTINIB获FDA突破性治疗认定
近日,Turning Point Therapeutics, Inc.的Repotrectinib获FDA突破性治疗认定(Breakthrough Therapy Designation,BTD),用于治疗ROS1阳性的转移性非小细胞肺癌(NSCLC)患者,这些患者包括此前接受过一种ROS1酪氨酸激酶抑制剂治疗或者没接受过铂类化疗的人。

来源:Turning Point Therapeutics官网
【FDA】Aptose的HM43239获FDA快速通道认定
近日,Aptose Biosciences Inc.的HM43239获FDA快速通道认定(Fast Track Designation,FTD),用于治疗FLT3变异的复发性或难治性急性髓性白血病(R/R AML)。HM43239是一种口服的髓系多激酶抑制剂。
![]()
来源:Aptose官网
【FDA】拜耳DAROLUTAMIDE补充新药申请获FDA优先审评认定
近日,拜耳口服雄激素受体抑制剂(ARi)Darolutamide和Docetaxel联用的补充新药申请(sNDA)获FDA优先审评(Priority Review)认定,用于治疗转移性激素敏感性前列腺癌(mHSPC)。
来源:BAYER官网
【FDA】阿斯利康IMFINZI补充生物制品许可申请获FDA优先审评认定
近日,阿斯利康Imfinzi(durvalumab)与标准化疗联用的补充生物制品许可申请(sBLA)获FDA优先审评认定,用于治疗局部晚期或转移性胆道癌(BTC)。

来源:阿斯利康官网
【NMPA】四款药物纳入拟优先审评品种
近日,四款药物纳入拟优先审评品种:
1. 深圳市康哲生物科技有限公司的甲氨蝶呤注射液(预充式),用于治疗对常规疗法不敏感的严重、顽固、致残性银屑病;
2. 石家庄四药有限公司的司替戊醇干混悬剂,与氯巴占和丙戊酸盐联合使用,作为婴儿严重肌阵挛性癫痫(SMEI,Dravet综合征)患者癫痫发作时,氯巴占和丙戊酸盐无法充分控制的难治性全身强直阵挛发作的辅助治疗;
3. 四川汇宇制药股份有限公司的硫代硫酸钠注射液,用于氰化物中毒,也可用于砷、汞、铅、铋、碘等中毒;
4. 宜昌人福药业有限责任公司的氯巴占片,用于2岁及以上Lennox-Gastaut 综合征(LGS)患者癫痫发作的联合治疗。
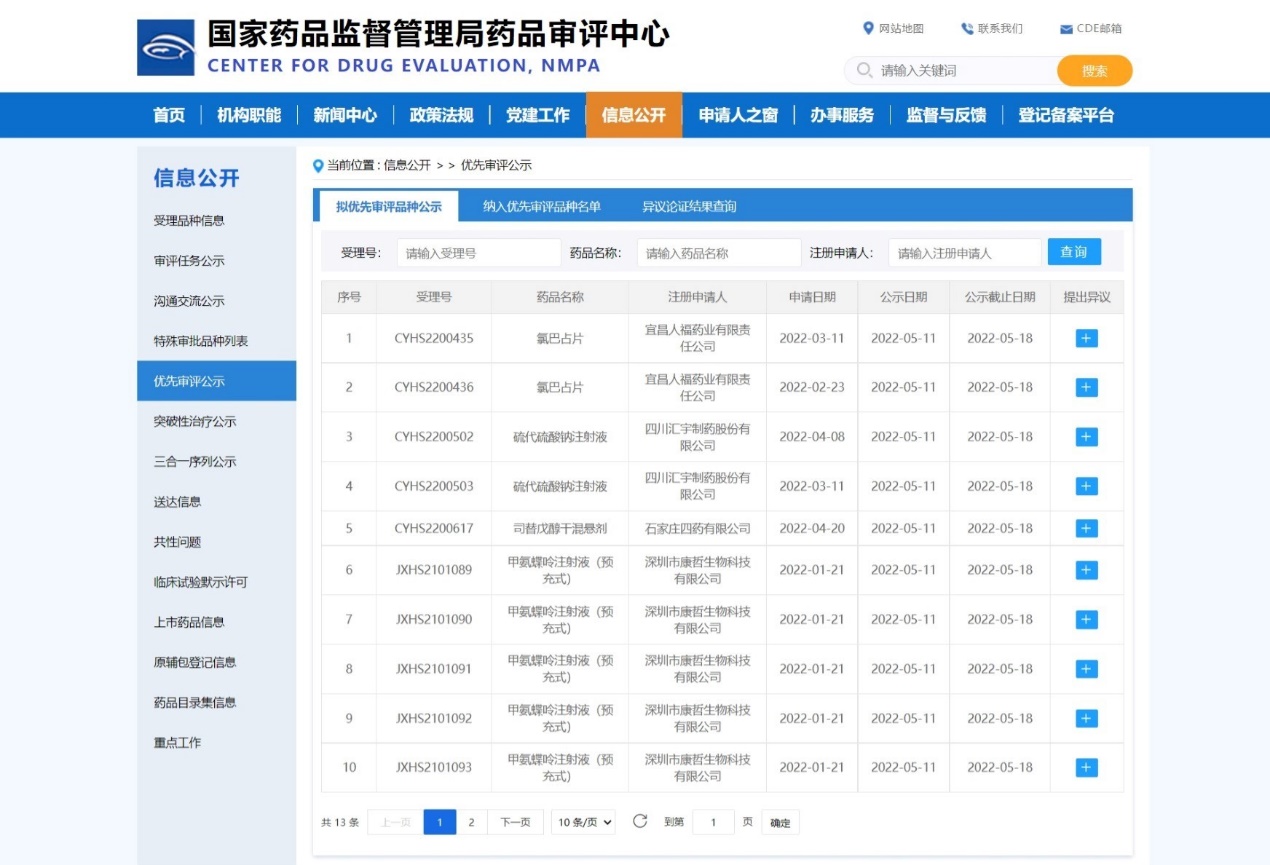
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731


