第48期 / 本文由奥来恩团队原创
本期看点:FDA发布行业指南草案提高临床试验中种族和族群多样性;NMPA正式发布《药品年度报告管理规定》;CAR T-细胞疗法YESCARTA®新适应症获FDA批准;信达达伯坦®(佩米替尼片)和辉瑞JAK1抑制剂阿布昔替尼片获NMPA批准;多款新药获药监机构特殊审评认定。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
重要会议
• FDA,2022.04.25-04.27,2022 FDA/DIA Oligonucleotide-based Therapeutics Conference.
https://www.fda.gov/drugs/news-events-human-drugs/2022-fdadia-oligonucleotide-based-therapeutics-conference-04252022
法规政策
【FDA】FDA发布行业指南草案提高临床试验中种族与族群多样性
近日,FDA发布最新的行业指南草案《临床试验中提高代表性不足的种族与族群受试者入组的多样性计划》(Diversity Plans to Improve Enrollment of Participantsfrom Underrepresented Racial and Ethnic Populations in Clinical Trials),旨在为申请人的医疗产品开发计划中纳入更多来自代表性不足的种族与族群的受试者提供参考建议。该指南建议申请人在临床试验研究的适用阶段,尽早向FDA递交一份种族和族群多样性计划。

来源:FDA官网
【NMPA】CDE正式发布《胰岛素类产品生物类似药药学研究与评价技术指导原则》
近日,为规范和指导胰岛素类产品生物类似药的研发、生产和注册,进一步明确技术评价标准,CDE正式发布了《胰岛素类产品生物类似药药学研究与评价技术指导原则》,涉及生产用原材料、生产工艺、质量标准、稳定性研究以及储存容器和密闭系统等方面。

来源:CDE官网
点击查看:
https://www.cde.org.cn/main/news/viewInfoCommon/14fe0217047454f6da511a05881dba6d
【NMPA】NMPA正式发布《药品年度报告管理规定》
近日,为贯彻落实《药品管理法》及《药品注册管理办法》《药品生产监督管理办法》有关要求,进一步指导药品上市许可持有人建立年度报告制度,NMPA发布了《药品年度报告管理规定》和《药品年度报告模板》,同时还启用了药品年度报告采集模块。
来源:NMPA官网
点击查看:
https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20220412172455115.html
新药审批
【FDA】CAR T-细胞疗法YESCARTA®新适应症获FDA批准
近日,Kite Pharma, Inc.的CAR T-细胞疗法Yescarta®(axicabtagene ciloleucel)获FDA批准,用于大B细胞淋巴瘤(LBCL)成人患者的二线治疗,这些患者对一线化学免疫治疗没有反应或在接受一线化学免疫治疗后12个月内复发。Yescarta®不适用于原发性中枢神经系统淋巴瘤患者的治疗。该申请此前曾获得孤儿药(Orphan Drug)、突破性治疗(Breakthrough Therapy)和优先审评(Priority Review)认定。

来源:FDA官网
【NMPA】信达达伯坦®(佩米替尼片)获NMPA批准
近日,信达生物制药集团的达伯坦®(佩米替尼片,pemigatinib)获NMPA批准,用于既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者的治疗。达伯坦®是首个在中国获批的选择性FGFR受体酪氨酸激酶抑制剂。

来源:NMPA官网
点击查看:
https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20220406084341107.html
【NMPA】辉瑞JAK1抑制剂阿布昔替尼片获NMPA批准
近日,NMPA通过优先审评审批程序批准辉瑞公司申报的1类创新药阿布昔替尼片(商品名:希必可/CIBINQO)上市,用于治疗对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人患者。
阿布昔替尼是Janus激酶(JAK)1抑制剂。JAK是一种细胞内酶,介导细胞膜上的细胞因子或生长因子受体相互作用而产生的信号传导,从而影响细胞造血功能和免疫细胞功能。阿布昔替尼通过阻断三磷酸腺苷(ATP)结合位点可逆性和选择性地抑制JAK1。
来源:NMPA官网
点击查看:
https://www.nmpa.gov.cn/yaowen/ypjgyw/20220411140856159.html
特殊审评
【FDA】复宏汉霖PD-1抑制剂斯鲁利单抗获FDA孤儿药认定
近日,复宏汉霖PD-1抑制剂汉斯状®(斯鲁利单抗)获FDA孤儿药认定(Orphan Drug Designation, ODD),用于治疗小细胞肺癌(SCLC)。

来源:复宏汉霖官网
点击查看:
https://www.henlius.com/en/NewsDetails-3525-26.html
【FDA】CAR T-细胞疗法PRGN-3006 UltraCAR-T®获FDA快速通道认定
近日,Precigen, Inc.的CAR T-细胞疗法PRGN-3006 UltraCAR-T®获FDA快速通道认定(Fast Track Designation, FTD),用于治疗复发性或难治性急性髓系白血病(r/r AML)。PRGN-3006此前曾获得FDA孤儿药认定。
来源:Precigen官网
【FDA】Dialectic Therapeutics的DT2216获FDA快速通道认定
近日,Dialectic Therapeutics, Inc.的DT2216获FDA快速通道认定,用于治疗外周T细胞淋巴瘤(PTCL)和皮肤T细胞淋巴瘤(CTCL)的成人患者。

来源:Dialectic官网
【NMPA】四款药物纳入拟突破性治疗品种
近日,四款药物纳入拟突破性治疗品种:
1. 正大天晴药业集团股份有限公司的TQB2450注射液,拟用于既往接受过一、二线化疗方案治疗失败或不能耐受的非微卫星高度不稳定(非MSI-H)或非DNA错配修复缺陷(非dMMR)的复发性或转移性子宫内膜癌的治疗;
2. 信达生物制药(苏州)有限公司的信迪利单抗注射液,拟用于经一线及以上含铂化疗失败或不能耐受的晚期宫颈癌的治疗;
3. 信达生物制药(苏州)有限公司的IBI310,拟用于经一线及以上含铂化疗失败或不能耐受的晚期宫颈癌的治疗;
4. 应世生物科技(上海)有限公司的IN10018片,拟用于铂耐药复发卵巢癌的治疗。

来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731
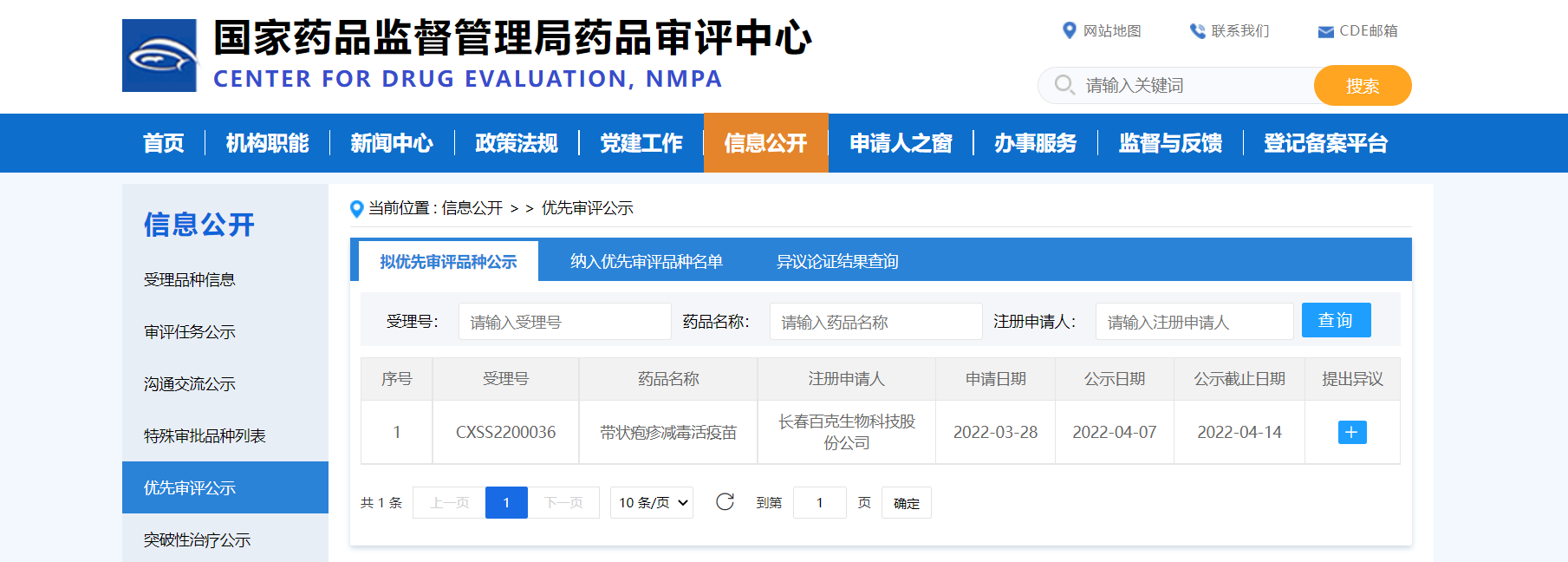
【NMPA】百克生物带状疱疹减毒活疫苗纳入拟优先审评品种
近日,长春百克生物科技股份公司的带状疱疹减毒活疫苗纳入拟优先审评品种,拟用于预防带状疱疹。
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731


