第47期 / 本文由奥来恩团队原创
本期看点:FDA发布最新行业指南《COVID-19疫苗的紧急使用授权》;首个LAG-3阻断抗体组合产品获FDA批准;KEYTRUDA®新适应症获FDA批准;诺华前列腺癌新药PLUVICTO获FDA批准;武田布格替尼片、复宏汉霖斯鲁利单抗注射液获NMPA批准;多款药物获药监机构特殊审评认定。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
重要会议
• FDA, 2022.04.06, The 16th Annual FDA/DIA Biostatistics Industry and Regulator Forum 2022 (CDER Co-Sponsorship).
https://www.fda./drugs/news-events-human-drugs/16th-annual-fdadia-biostatistics-industry-and-regulator-forum-2022-cder-co-sponsorship-04062022
• FDA, 2022.04.13, Biosimilars: A Decade of Experience and Future Directions-Strategies for Improving Biosimilar Adoption and the Potential Role of Clinical Pharmacology.
https://www.fda.gov/drugs/news-events-human-drugs/biosimilars-decade-experience-and-future-directions-strategies-improving-biosimilar-adoption-and
COVID-19
【FDA】最新行业指南《预防COVID-19疫苗的紧急使用授权》发布
3月31日,FDA发布了关于预防COVID-19疫苗的最新行业指南。该指南提供了用于预防COVID-19的疫苗获得紧急使用授权(EmergencyUse Authorization, EUA)应满足的要求,包括对支持EUA授予的数据与信息的建议,获得EUA后继续开展临床试验以及对EUA申请召开FDA专家委员会等相关内容的考量。该最新指南将取代FDA于2021年5月发布的行业指南《预防COVID-19疫苗的紧急使用授权》。

来源:FDA官网
新药审批
【FDA】首个LAG-3阻断抗体组合产品获FDA批准
3月18日,百时美施贵宝Opdualag™(nivolumab和relatlimab-rmbw联用)获FDA批准,用于治疗成人和12岁及以上儿童患者的不可切除或转移性黑色素瘤。Opdualag™是首个获得FDA批准的LAG-3(淋巴细胞活化基因3)阻断抗体组合产品,nivolumab(纳武利尤单抗)为PD-1抑制剂,relatlimab为LAG-3阻断抗体。

来源:百时美施贵宝官网
【FDA】默沙东KEYTRUDA®新适应症获FDA批准
3月21日,默沙东的KEYTRUDA®(pembrolizumab)新适应症获批,用于治疗晚期子宫内膜癌患者,这些患者经检测确定为微卫星高度不稳定(microsatellite instability-high, MSI-H)或错配修复蛋白缺失(deficient mismatch repair, dMMR),并且先前经各种系统治疗后疾病进展且不适合根治性手术或放疗。

来源:Merck官网
【FDA】诺华前列腺癌新药PLUVICTO获FDA批准
3月23日,诺华的Pluvicto(lutetium Lu 177 vipivotide tetraxetan)获FDA批准,用于治疗前列腺特异性膜抗原(PSMA)阳性、转移性去势抵抗性前列腺癌(mCRPC)患者,这些患者已经接受过雄激素受体(AR)通路抑制治疗和紫杉烷类化疗。该药曾获得突破性疗法认定(Breakthrough Designation)与优先审评(Priority Review)。

来源:FDA官网
【NMPA】武田布格替尼片获NMPA批准
近日,武田制药抗肿瘤新药安伯瑞®(布格替尼片/Brigatinib)正式获NMPA批准,用于单药治疗间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性的非小细胞肺癌(NSCLC)患者。
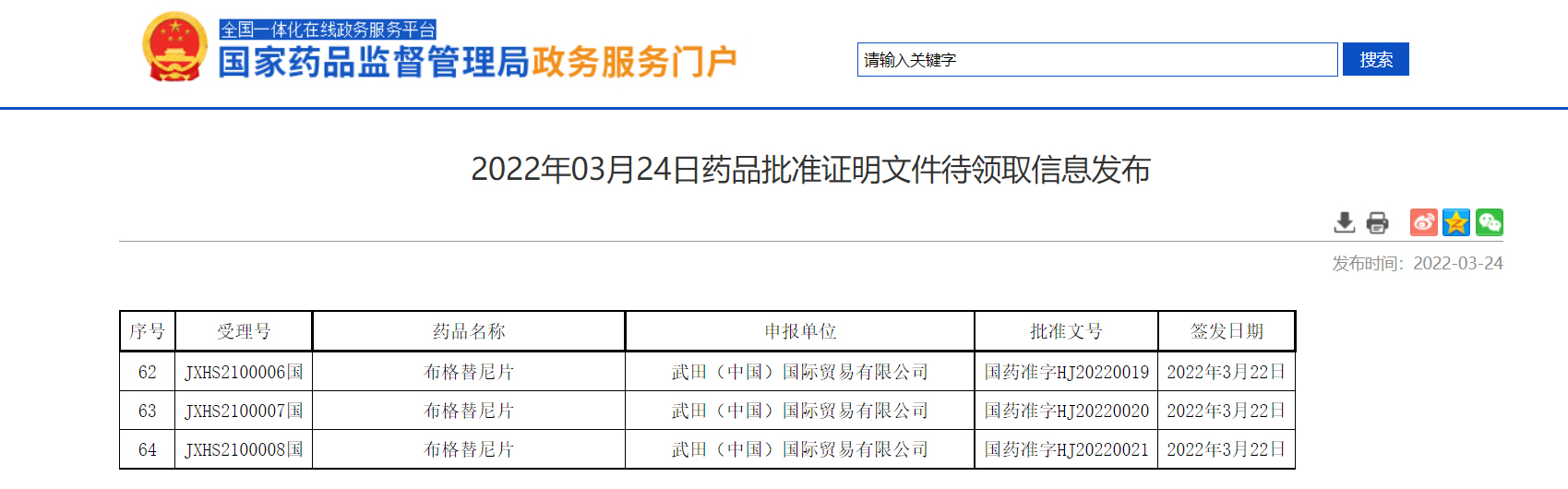
来源:NMPA官网
点击查看:
https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20220324160221168.html
【NMPA】复宏汉霖斯鲁利单抗注射液获NMPA批准
近日,复宏汉霖旗下首款自主研发的创新生物药PD-1抑制剂H药——汉斯状®(通用名:斯鲁利单抗注射液)正式获NMPA批准,用于既往标准治疗失败的、不可切除或转移性微卫星高度不稳定(MSI-H)的成人晚期实体瘤。
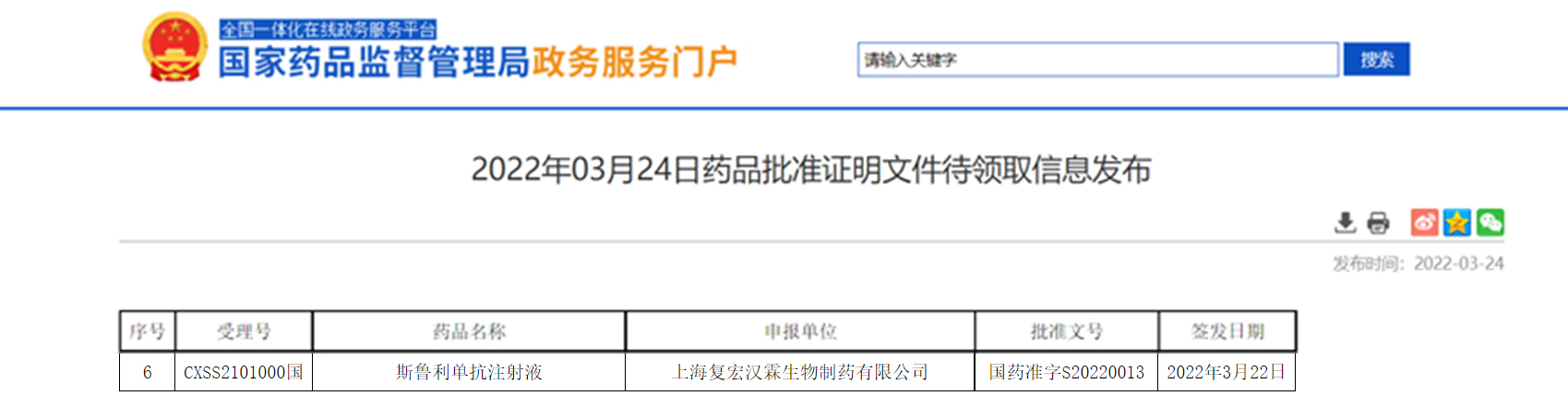
来源:NMPA官网
点击查看:
https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20220324160221168.html
特殊审评
【FDA】Noxopharm的VEYONDA®获FDA孤儿药认定
近日,Noxopharm Limited的Veyonda®获FDA孤儿药认定(Orphan Drug Designation, ODD),用于治疗软组织肉瘤。

来源:NOXOPHARM官网
【FDA】Taiho Pharmaceutical的FUTIBATINIB获FDA优先审评认定
近日,Taiho Pharmaceutical Co., Ltd.的抗肿瘤产品Futibatinib (TAS-120)获FDA优先审评认定(Priority Review),用于既往接受过治疗的局部晚期或转移性胆管癌(CCA)患者,这些患者携带FGFR2(Fibroblast Growth Factor Receptor 2,成纤维细胞生长因子受体2)基因重排,包括基因融合。

来源:Taiho官网
点击查看:
https://www.taiho.co.jp/en/
【NMPA】两款药物纳入拟突破性治疗品种
近日,CDE信息公示,两款药物纳入拟突破性治疗品种:
1. 上海明聚生物科技有限公司的JWCAR029(CD19靶向嵌合抗原受体T细胞),拟用于经过二线及以上治疗的成人复发难治性套细胞淋巴瘤;
2. 复星凯特生物科技有限公司的FKC889,拟用于复发/难治性套细胞淋巴瘤。
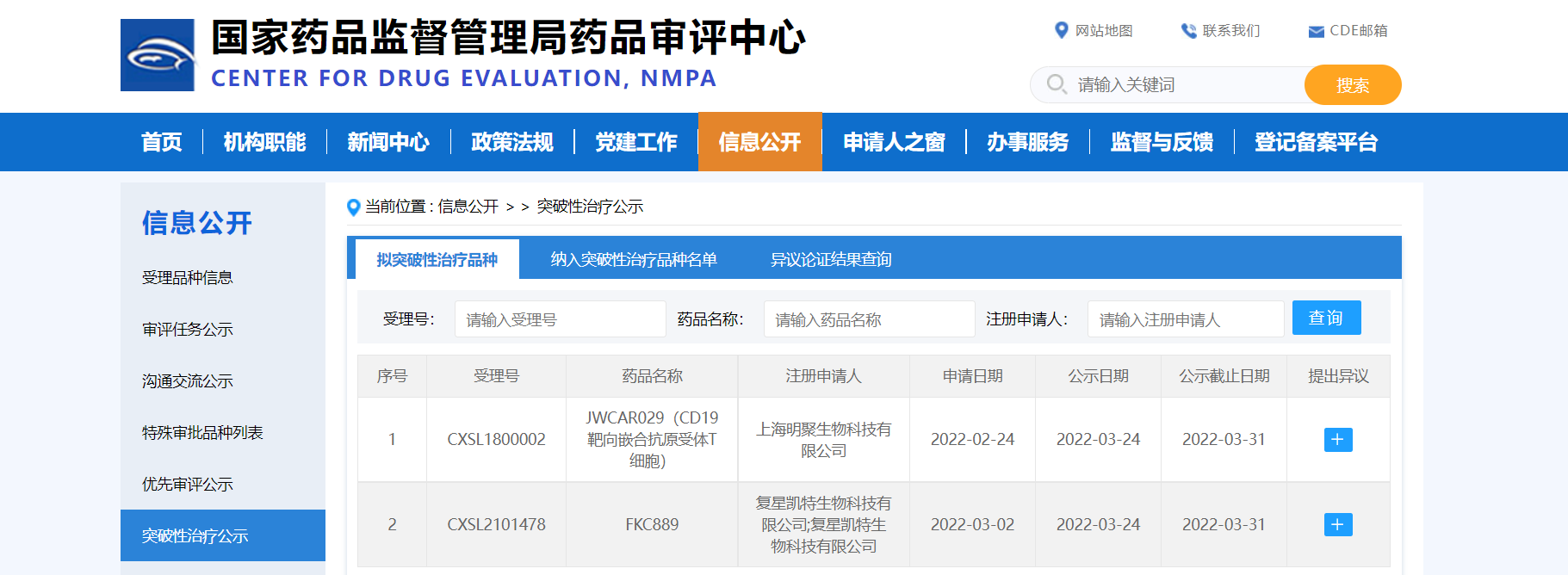
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/da6efd086c099b7fc949121166f0130c
【NMPA】两款药物纳入拟优先审评品种
近日,CDE信息公示,两款药物纳入拟优先审评品种:
1. 上海药明巨诺生物科技有限公司的瑞基奥仑赛注射液,拟用于经过二线或以上系统性治疗的成人复发或难治性滤泡淋巴瘤,包括组织学分级为1、2、3a级的滤泡性淋巴瘤;
2. 杭州泰格医药科技股份有限公司的蔗糖氢氧化氧铁咀嚼片,拟用于高磷血症。
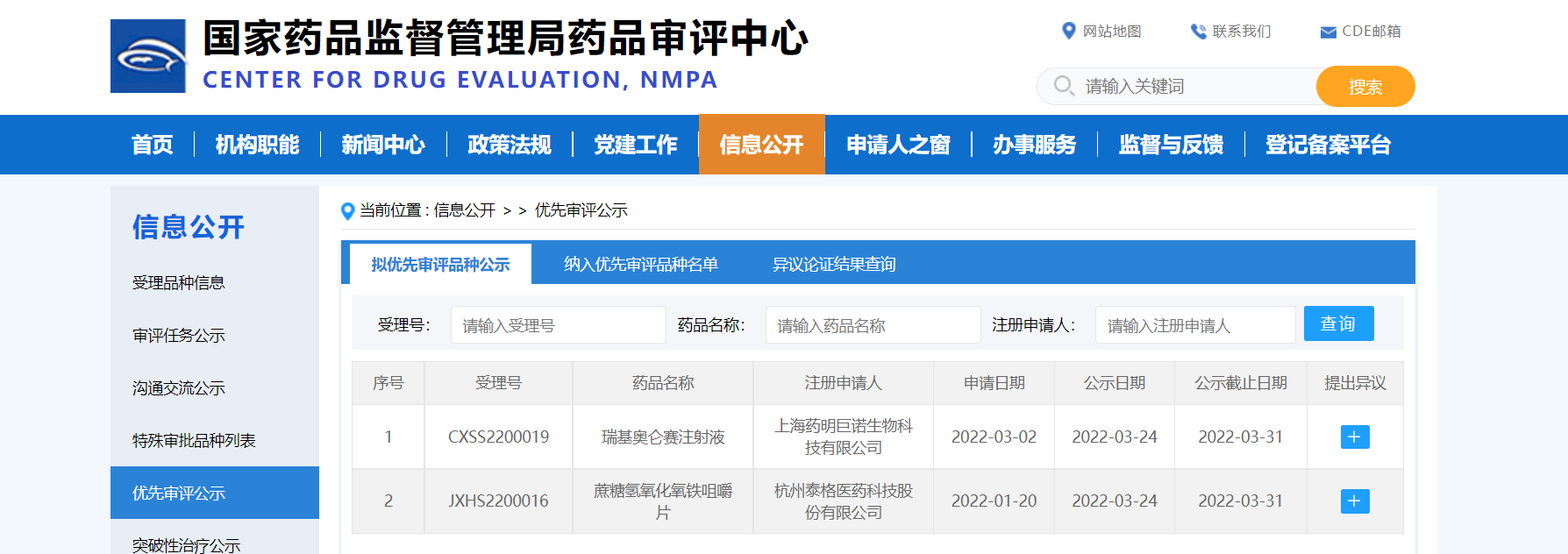
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/da6efd086c099b7fc949121166f0130c


