第46期 / 本文由奥来恩团队原创
本期看点:FDA发布两篇行业指南草案,分别关于CAR T和基因治疗产品;阿斯利康和默沙东联合开发的乳腺癌新药获FDA批准;全球首个基础胰岛素GLP-1RA注射液获NMPA批准;多款新药获药监机构特殊审评认定。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
法规政策
【FDA】FDA发布关于CAR T细胞产品研发的行业指南草案
近日,FDA发布行业指南《CAR(Chimeric Antigen Receptor)T细胞产品研发的考量》草案。该指南旨在协助申请人开发CAR T细胞产品,其中针对性地提供了关于化学成分、生产制造与质量控制(CMC)、药理学和毒理学以及临床(包括临床药理学)研究的建议。此外,指南中的很多信息同样也适用于其他基因修饰的淋巴细胞产品,比如CAR NK(NaturalKiller)细胞或TCR(T Cell Receptor)修饰的T细胞。

来源:FDA官网
【FDA】FDA发布关于人类基因治疗产品的行业指南草案
近日,FDA发布最新行业指南《涉及人类基因组编辑的人类基因治疗产品》草案,为申请人开发结合人类体细胞基因组编辑(Genome Editing, GE)的人用基因治疗产品提供建议。该指南主要针对在研究性GE产品的IND(Investigational New Drug)申请中应该包含哪些信息用于评估其安全性和质量给出明确的建议。这些信息涉及产品设计、化学成分、生产制造与质量控制(CMC)、产品测试等研发内容,以及临床前研究和临床试验研究等。
来源:FDA官网
新药审批
【FDA】首个在早期乳腺癌中靶向BRCA的药物获批
近日,阿斯利康和默沙东联合开发的Lynparza(olaparib)获FDA批准,用作BRCA种系突变(Germline BRCA-mutated, gBRCAm)、HER2阴性的高危早期乳腺癌患者的辅助治疗,这些患者在手术前或术后已经接受过化疗。Lynparza是唯一获批在早期乳腺癌中靶向BRCA的药物。

来源:阿斯利康官网
【NMPA】全球首个基础胰岛素GLP-1RA注射液诺和益®中国上市
近日,诺和诺德宣布,全球首个基础胰岛素GLP-1RA注射液诺和益®(德谷胰岛素利拉鲁肽注射液)正式在中国上市,用于血糖控制不佳的成人2型糖尿病患者(T2DM),在饮食和运动基础上联合其他口服降糖药物,改善血糖控制。
诺和益®融合了德谷胰岛素和利拉鲁肽双组分的优势,各自独立发挥降糖作用,同时改善胰岛素抵抗和β细胞障碍。

来源:诺和诺德官网
特殊审评
【FDA】天境生物双特异性抗体TJ-CD4B获FDA孤儿药认定
近日,天境生物公司的创新双特异性抗体TJ-CD4B获FDA孤儿药认定,用于治疗胃癌(包括胃食管交界处癌)。TJ-CD4B是靶向肿瘤抗原密蛋白18剪切体2(Claudin 18.2)和T细胞共刺激分子4-1BB的双抗,能同时与这两个靶点特异结合,增加T淋巴细胞肿瘤浸润并发挥肿瘤杀伤作用。

来源:天境生物官网
【FDA】Genmab的Epcoritamab获FDA孤儿药认定
近日,由Genmab A/S和Abbiveiane联合开发的Epcoritamab(DuoBody®-CD3xCD20)获FDA孤儿药认定,用于治疗滤泡性淋巴瘤(follicular lymphoma, FL)。

来源:Genmab官网
【FDA】7 Hills Pharma的7HP349获FDA快速通道认定
近日,7 HillsPharma LLC的免疫刺激剂7HP349获FDA快速通道认定(Fast Track Designation),与一种CTLA-4抑制剂联用,作为手术不可切除或转移性恶性黑色素瘤患者接受PD-1抑制剂治疗失败后的治疗手段。

来源:7 Hills Pharma官网
【NMPA】诺华LNP023胶囊纳入拟突破性治疗品种
近日,CDE信息公示,诺华(中国)生物医学研究有限公司的LNP023胶囊纳入拟突破性治疗品种,拟用于治疗C3肾小球病(C3G)。
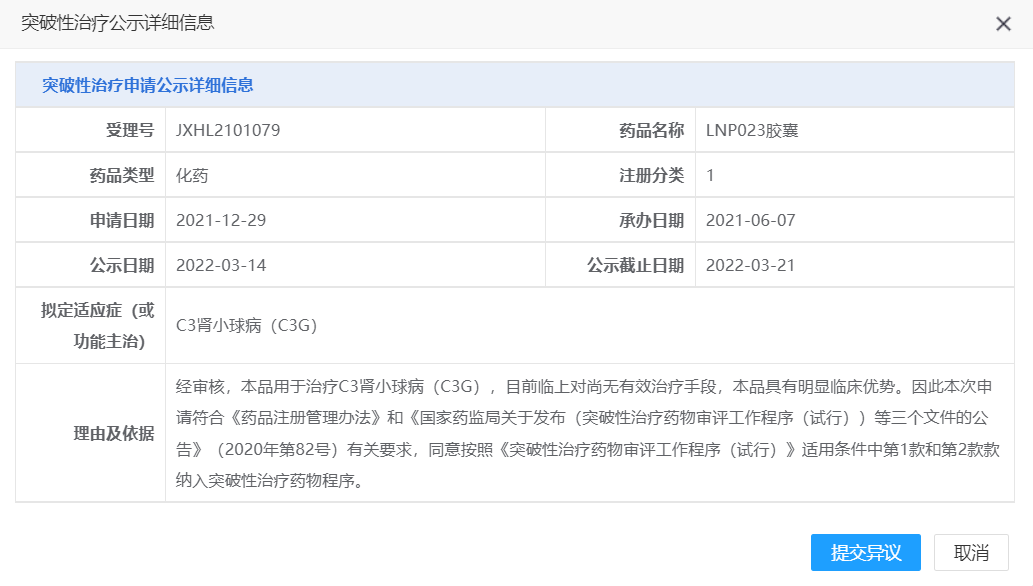
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731


