第42期 / 本文由奥来恩团队原创
本期看点:CDE发布《罕见疾病药物临床研发技术指导原则》,促进罕见病药物研发;维迪西妥单抗成为国内首个靶向HER2治疗尿路上皮癌的ADC药物;国内外多款药物获得药监机构特殊审评认定。
法规政策
【NMPA|指导原则】CDE正式发布罕见病药物最新临床研发指导原则
罕见疾病的单病种发病率极低,药物研发的难度远远超过常见多发疾病,因此罕见疾病药物的临床研发,除了应遵循一般药物的研发规律以外,更应密切结合其自身疾病特点,在确保严谨科学的基础上,采用更为灵活的设计,以通过有限的患者数据,获得更加充分的科学证据,满足获益与风险的评估,支持监管决策。为促进罕见疾病药物研发,CDE正式发布了《罕见疾病药物临床研发技术指导原则》。

来源:CDE官网
点击查看:
https://www.cde.org.cn/main/news/viewInfoCommon/c4e1ef312a0a0c039a7a4ca55b91d4e8
中美双报、新药注册,IND/NDA/BLA申报,尽在奥来恩!
新药审批
【NMPA|上市】荣昌生物维迪西妥单抗新适应症获NMPA批准
1月5日,荣昌生物制药(烟台)股份有限公司宣布其注射用维迪西妥单抗新适应症获NMPA批准,用于治疗既往接受过含铂化疗且HER2过表达即免疫组化检查结果为2+或3+的局部晚期或转移性尿路上皮癌患者。维迪西妥单抗成为国内首个靶向HER2治疗尿路上皮癌的ADC药物,开启了我国尿路上皮癌精准治疗的新时代。

来源:荣昌生物官网
点击查看:
http://www.remegen.cn/Invest2.aspx?ID=454
【FDA|特殊审评】Cullinan Oncology的CLN-081获FDA突破性治疗认定
1月4日,Cullinan Oncology, Inc.的CLN-081获FDA突破性治疗认定,用于治疗具有表皮生长因子(epidermal growth factor, EGFR)外显子 20 插入突变且先前接受过铂类全身化疗的局部晚期或转移性非小细胞肺癌(NSCLC)患者。

来源:Cullinan官网
【FDA|特殊审评】AbbVie ADC新药获FDA突破性治疗认定
1月4日,AbbVie的Telisotuzumab Vedotin (Teliso-V)获FDA突破性治疗认定,用于治疗晚期/转移性表皮生长因子受体(EGFR)野生型、非鳞状非小细胞肺癌 (NSCLC) 患者,这些患者c-Met 过表达、且其疾病在铂类治疗期间或之后进展。
Teliso-V是一款创新型抗体偶联药物(antibody-drug conjugate, ADC),它所靶向的c-Met是一种在包括NSCLC在内的肿瘤中过表达的受体酪氨酸激酶。

来源:AbbVie官网
【FDA|特殊审评】Veru的ENOBOSARM获FDA快速通道认定
1月10日,Veru Inc.的Enobosarm获FDA快速通道认定,用于治疗雄激素受体(AR)阳性、雌激素受体(ER)阳性、人表皮生长因子受体(HER2)阴性(AR+ER+HER2-)的转移性乳腺癌患者。这些患者在接受过非甾体芳香化酶抑制剂、氟维司群和CDK4/6抑制剂治疗后病情进展,且乳腺癌组织中AR核染色在40%或以上。Enobosarm是一种雄激素受体靶向激动剂。
来源:Veru官网
【FDA|特殊审评】CBMG的C-CAR039获FDA再生医疗先进疗法认定和快速通道认定
1月12日,Cellular Biomedicine Group Inc.的C-CAR039获FDA再生医疗先进疗法认定和快速通道认定,用于治疗复发或难治性弥漫性大 B 细胞淋巴瘤(r/r DLBCL)。C-CAR039是一种针对 CD19 和 CD20 抗原的新型自体双特异性 CAR-T 疗法。

来源:CBMG官网
点击查看:
https://www.cellbiomedgroup.com/newsroom/fda-rmat?lang=en
【FDA|特殊审评】ENHERTU®补充生物制品许可申请获FDA优先审评认定
1月17日,Daiichi Sankyo Company, Limited和AstraZeneca宣布其共同开发的ENHERTU®的补充生物制品许可申请(supplementalBiologics License Application, sBLA)获FDA优先审评认定,用于治疗手术不可切除或转移性HER2阳性的乳腺癌成人患者,这些患者先前接受过抗HER2的方案治疗。

来源:Daiichi Sankyo官网
点击查看:
https://www.daiichisankyo.com/media/
【FDA|特殊审评】自然杀伤(NK)细胞疗法新药获FDA快速通道认定
1月18日,Celularity Inc.的CYNK-101获FDA快速通道认定,与标准化疗、Trastuzumab 和 Pembrolizumab联用,用于一线治疗局部晚期不可切除或转移性 HER2/neu 阳性胃癌或胃食管结合部(G/GEJ)腺癌患者。

来源:Celularity官网
【NMPA|特殊审评】三款药物纳入突破性治疗品种
近日,三款药物纳入突破性治疗品种:
1. 南京圣和药业股份有限公司的SHC014748M胶囊,拟用于治疗既往接受至少二线治疗后复发难治的滤泡性淋巴瘤患者;
2. 百济神州(北京)生物科技有限公司的BGB-3111胶囊,拟用于治疗新诊断慢性淋巴细胞白血病/小淋巴细胞淋巴瘤成人患者;
3. 和记黄埔医药(上海)有限公司的HMPL-523乙酸盐片,拟用于治疗既往接受过一线标准治疗(糖皮质激素、免疫球蛋白)无效或复发的成人原发慢性免疫性血小板减少症。
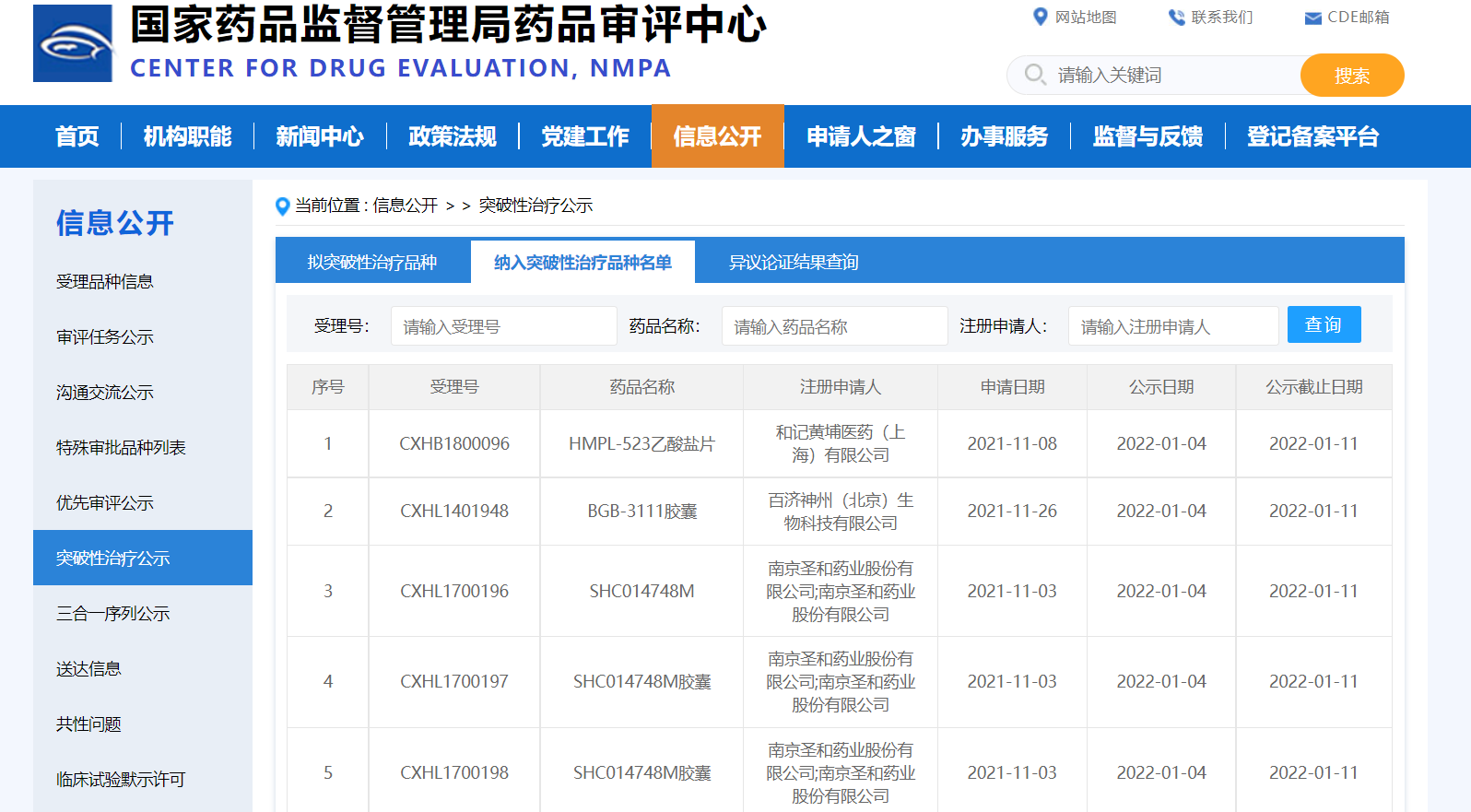
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731
【NMPA|特殊审评】两款药物纳入优先审评品种
近日,两款药物纳入优先审评品种:
1. 深圳赛诺菲巴斯德生物制品有限公司的四价流感病毒裂解疫苗,拟用于流行性感冒的预防,适用于6~35月龄人群主动免疫,尤其推荐易发生流感相关并发症的人群;
2. 北海康成(苏州)生物制药有限公司的马昔巴特口服液,拟用于治疗1岁及以上Alagille综合征 (阿拉杰里综合征) 患者胆汁淤积性瘙痒。

来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731


