12月23日,星期四,美国食品药品监督管理局(FDA)就一款抗体偶联药物(Antibody Drug Conjugate, ADC)的IND(Investigational New Drug)申请向Aleon发出药物临床试验批准通知书(Study May Proceed letter),该申请的准备和递交均由Aleon团队(上奥来恩医药了解业务范围)完成。ADC是一种新型的药物,主要用于对癌细胞的靶向治疗。癌症药物如果具有更强的细胞毒性,一般会更有效,但也会对服用它的病人造成伤害。为了保护病人,ADC被设计成非常有效的小分子药物和具有高度特异性的抗体,从而只针对目标细胞。由于ADC的复杂性,如果没有一个经验丰富的团队的支持,会使IND的难度大大增加。
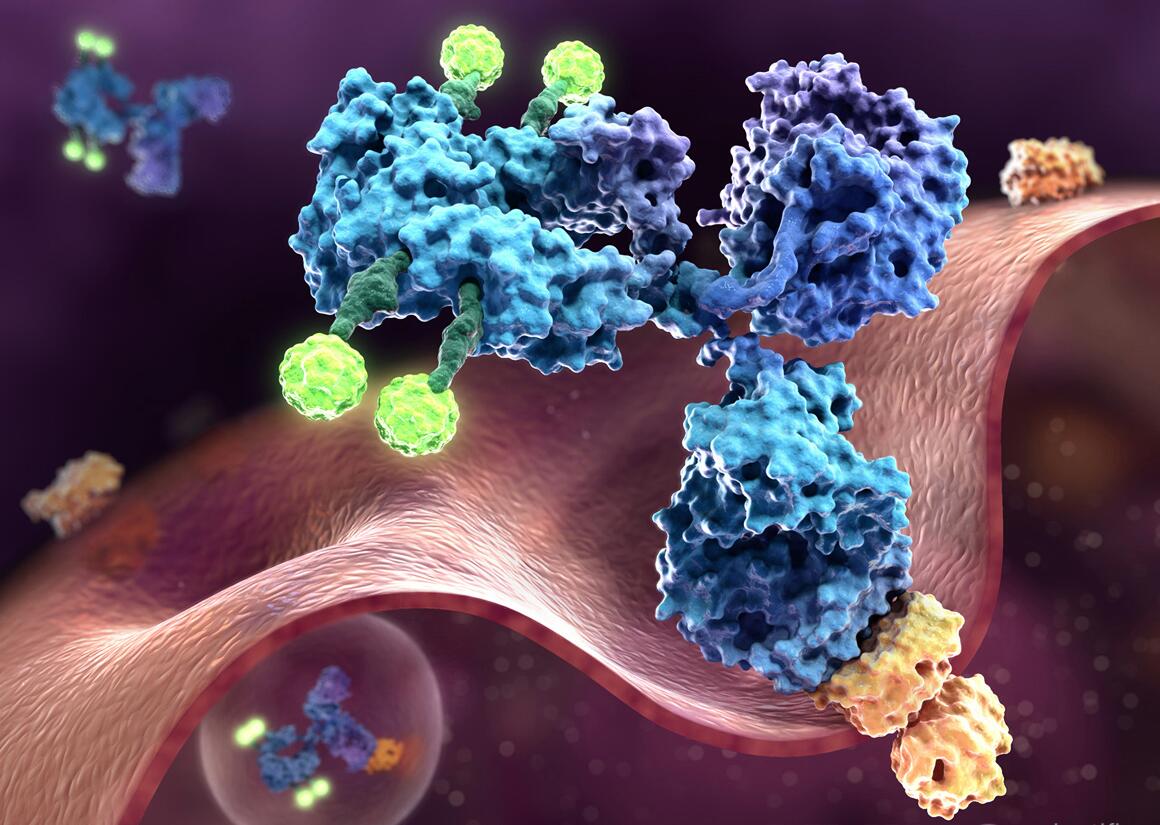
IND申报材料中的CMC(化学成分生产和控制)部分受到的影响最大,需要完成三个独立的原料药(Drug Substances)部分,就像它们是独立的新药实体一样——一个是抗体的,一个是与活性物质连接的中间体,一个是实际的ADC活性物质。然而,ADC在此基础上需要更多考量。申报内容通常包括药物与抗体的比例、药物结合部位、药物分布、偶联物对抗体结合能力的影响,以及制剂和人体血浆中游离药物/抗体的数量。如果申办方以前没有经历过这个过程,像这样的CMC要求会给IND申请带来很多模糊性,而这种模糊性会导致申请延误或直接被拒绝。
在计划递交一项药政申请时,仅仅意识到这些不同的方面是不够的,只有时刻考虑到FDA的审批程序才能起草出高质量的CMC部分。这是一件很棘手的事情,因为FDA没有发布任何关于ADC的指南,且相关申请是由药品评价和研究中心(CDER)的两个不同办公室审查,分别是生物技术产品办公室(the Office of Biotechnology Products, OBP)和新药质量评估办公室(the Office of New Drug Quality Assessment, ONDQA)。这两个办公室对IND申请都有要求,申办方应在30天的审查期内期待这两个办公室给出意见。像Aleon这样的咨询团队对于从事新型ADC研究的申办方具有很大的价值,因为他们已经经历了递交的过程,可以利用他们的专业知识确保首次递交就能成功。


