第41期 / 本文由奥来恩团队原创
本期看点:COVID-19疫情方面,AstraZeneca疫苗获FDA紧急使用授权,NMPA应急批准新冠病毒中和抗体联合治疗药物安巴韦单抗注射液(BRII-196)及罗米司韦单抗注射液(BRII-198);法规政策方面,NMPA发布新冠病毒药物研究与评价指导原则;新药审批方面,首个靶向卵巢癌的荧光成像剂获FDA批准,罕见病新药注射用司妥昔单抗获NMPA附条件批准上市,多款新药获得药监部门特殊审评认定。
COVID-19
用于特定人群COVID-19暴露前预防的长效单克隆抗体获FDA紧急使用授权
12月8日,AstraZeneca的Evusheld(tixagevimab与cilgavimab共同包装并联合给药)获FDA紧急使用授权(EUA),用于特定成人和儿童(12岁及以上并且体重至少40公斤,约88磅)群体COVID-19暴露前的预防。
该产品仅被授权用于目前未感染SARS-CoV-2病毒和最近未接触过SARS-CoV-2病毒感染人群的群体。此次授权使用还要求相应群体:
• 免疫系统中度至重度受损——由于某种疾病或者接受免疫抑制的治疗并且可能无法对COVID-19疫苗产生足够的免疫反应;或者
• 对COVID-19疫苗和/或疫苗组分有严重的过敏史,所以不推荐接种目前已经批准、或获得EUA授权的COVID-19疫苗。

来源:FDA官网
FDA扩大礼来两款单克隆抗体紧急使用授权
近日,FDA扩大了Eli Lilly and Co.两款单克隆抗体Bamlanivimab和Etesevimab的紧急使用授权(Emergency Use Authorization,EUA),允许这两款单抗联合用于所有12岁以下儿童患者(包括新生儿)轻到中度COVID-19的治疗以及暴露后预防,这些患者COVID-19检测阳性且有很高的风险发展为重症(包括住院和死亡)。此前,FDA曾授权这两款单抗用于12岁及以上且体重至少40 公斤的儿童患者COVID-19暴露后预防。

来源:FDA官网
NMPA应急批准腾盛华创医药技术(北京)有限公司新冠病毒中和抗体联合治疗药物安巴韦单抗注射液(BRII-196)及罗米司韦单抗注射液(BRII-198)注册申请
12月8日,国家药品监督管理局应急批准腾盛华创医药技术(北京)有限公司新冠病毒中和抗体联合治疗药物安巴韦单抗注射液(BRII-196)及罗米司韦单抗注射液(BRII-198)注册申请。这是我国首家获批的自主知识产权新冠病毒中和抗体联合治疗药物。
国家药监局根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,批准上述两个药品联合用于治疗轻型和普通型且伴有进展为重型(包括住院或死亡)高风险因素的成人和青少年(12—17岁,体重≥40kg)新型冠状病毒感染(COVID-19)患者。其中,青少年(12—17岁,体重≥40kg)适应症人群为附条件批准。

来源:NMPA官网
点击查看:
https://www.nmpa.gov.cn/yaowen/ypjgyw/20211208212528103.html
中美双报、新药注册,IND/NDA/BLA申报,尽在奥来恩!
法规政策
【NMPA|指导原则】CDE正式发布基因治疗与基因修饰细胞治疗产品非临床研究指导原则
近日,为规范国内基因治疗产品非临床研究与评价,引导行业健康发展,CDE正式发布《基因治疗产品非临床研究与评价技术指导原则(试行)》和《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》。
基因治疗产品非临床研究指导原则适用于除基因修饰细胞以外的基因治疗产品,不适用于化学合成的寡核苷酸及其类似物、预防性疫苗,并从非临床研究和支持临床试验的非临床考虑进行了描述。
基因修饰细胞治疗产品非临床研究指导原则主要包括六个部分:受试物、动物种属/模型选择、非临床有效性与概念验证、非临床药代动力学、非临床安全性以及对特定类型基因修饰细胞产品的特殊考虑。
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/news/viewInfoCommon/41bc557bec23a6ebfb0e148cc989f041
【NMPA|指导原则】CDE发布抗新冠病毒药物研究与评价指导原则
近日,鉴于国内国际新冠疫情的发生发展及临床治疗需求,CDE组织发布了《抗新冠病毒化学药物非临床药效学研究与评价技术指导原则(试行)》、《抗新冠病毒肺炎炎症药物非临床药效学研究与评价技术指导原则(试行)》、《新型冠状病毒中和抗体类药物非临床研究技术指导原则(试行)》。
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/news/viewInfoCommon/9d4a3e20cb73ed0636125abbcb256b60
新药审批
【FDA|上市】手术中的GPS!首个靶向卵巢癌荧光成像剂获FDA批准
11月29日,On Target Laboratories, Inc.的Cytalux™ (pafolacianine)获FDA批准,用于帮助外科医生鉴别卵巢癌病变。Cytalux是一种成像药物,可以提高定位能力,发现通常在术中难以被检测到的卵巢癌组织。
Cytalux采用静脉注射的方式在术前给药,帮助医生在术中确定卵巢癌病变位置。在参与试验的134名女性患者中,26.9%的病人在使用Cytalux后发现了至少一处正常手段无法检测到的病变部位。该申请此前曾获得FDA孤儿药、快速通道和优先审评认定。
来源:FDA官网
【FDA|上市】用于儿童患者!利妥昔单抗与化疗联用获FDA批准
近日,Genentech, Inc.的利妥昔单抗(rituximab)与化疗联用获FDA批准用于儿童患者(年龄≥6个月但≤18岁),治疗先前未接受过治疗且处于进展期的CD20阳性的弥漫性大B细胞淋巴瘤(large B-cell lymphoma, DLBCL)、伯基特淋巴瘤(Burkitt lymphoma, BL)、伯基特样淋巴瘤(Burkitt-like lymphoma, BLL)、成熟B细胞急性白血病(B-cell acute leukemia, B-AL)。该申请此前曾获得FDA优先审评认定。

来源:FDA官网
【NMPA|上市】罕见病新药!注射用司妥昔单抗附条件批准上市
近日,NMPA通过优先审评审批程序批准临床急需罕见病药品注射用司妥昔单抗的进口注册申请,用于人体免疫缺陷病毒(HIV)阴性和人疱疹病毒8型(HHV-8)阴性的多中心Castleman病(MCD)成人患者。
MCD是一种以淋巴组织生长为特征的罕见病,多数患者出现多器官损害且预后差,部分患者会转化为恶性淋巴瘤。注射用司妥昔单抗是一种人-鼠嵌合单克隆抗体,可阻断人白细胞介素-6(IL-6)与IL-6受体相结合,对IL-6产生抑制作用,继而抑制细胞生长。
来源:NMPA官网
点击查看:
https://www.nmpa.gov.cn/yaowen/ypjgyw/20211202084021193.html
【FDA|特殊审评】软骨肉瘤新药获FDA孤儿药认定
12月1日,Inhibrx, Inc.的INBRX-109获FDA孤儿药认定,用于治疗软骨肉瘤(chondrosarcoma)。软骨肉瘤是一种恶性骨肿瘤,从软骨细胞或间胚叶组织发生,并起源于躯体任何软骨内化骨的骨骼,可能与染色体的异常有关。
在美国和欧盟,每年约有2800名新增确诊患者,且目前尚无已批准的治疗手段。

来源:Inhibrx官网
【FDA|特殊审评】胶质母细胞瘤新药获FDA快速通道认定
12月6日,Sapience Therapeutics, Inc.的ST101获FDA快速通道认定,用于治疗复发性胶质母细胞瘤(glioblastoma, GBM)。
GBM是一种最常见也是最具侵袭性的脑癌。胶质母细胞瘤的体征和症状最初呈非特异性。患者可能会出现头痛、人格改变、恶心、有类似中风等症状,且症状通常会快速加重,还可能会发展为意识不清。
来源:Sapience Therapeutics官网
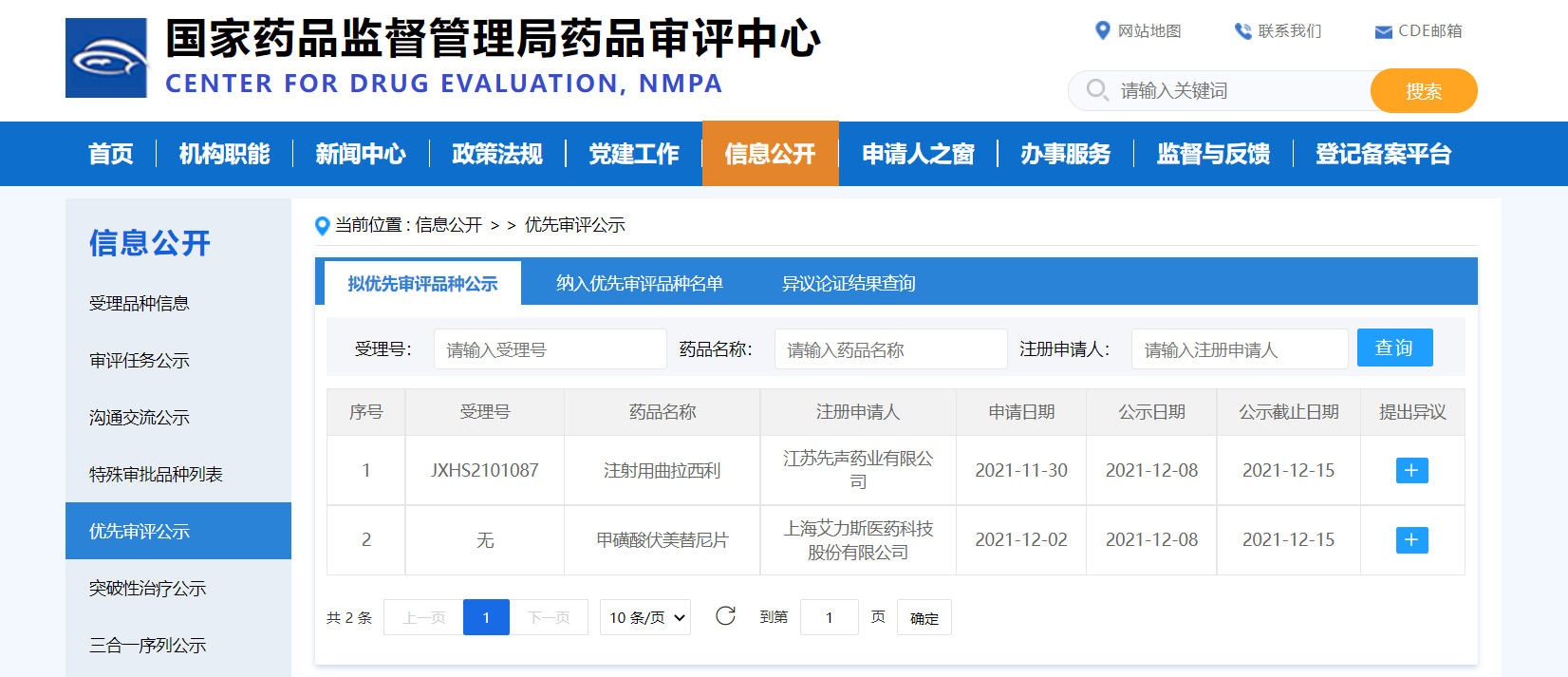
【NMPA|特殊审评】两款药物纳入拟优先审评品种
近日,CDE公示,两款药物纳入拟优先审评品种:
• 江苏先声药业有限公司的注射用曲拉西利,拟在接受含铂类药物联合依托泊苷方案的广泛期小细胞肺癌(ES-SCLC)患者中预防性使用曲拉西利(Trilaciclib),以降低化疗引起的骨髓抑制的发生率;
• 上海艾力斯医药科技股份有限公司的甲磺酸伏美替尼片,拟用于具有表皮生长因子受体(EGFR)外显子19缺失突变(19DEL)或外显子21置换突变(21L858R)的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731
近期会议
• FDA, 2021.12.14, Conversation on Cancer: “50 Years and Counting: Engaging theGenerations on Future Cancer Equity Opportunities”


