FDA CDER为应对COVID-19做了哪些工作?
近期,FDA CDER发布了一张信息图,图中从十个方面总结描述了FDA CDER在2020年1月1日至2021年9月30日期间为应对COVID-19所做的工作,其中涉及内容包括治疗产品开发、法规灵活性、仿制药批准、假药问题、网上药店、消毒洗手液、生产短缺、监测和流行病学、美国公共卫生服务部队部署以及与公众的参与互动。其中,11款治疗产品获得FDA紧急使用授权(EUA),并有1款产品获得FDA批准上市;批准了一千余仿制药申请和补充申请,用于COVID-19相关治疗与支持性治疗。

来源:FDA官网
Pfizer-BioNTech的COVID-19疫苗获FDA紧急使用授权用于儿童
10月29日,Pfizer-BioNTech的COVID-19疫苗获FDA紧急使用授权(EUA)用于5至11岁儿童。对于该年龄群体,计划接种两针,每针剂量为10微克(10 μg),间隔21天。该疫苗是美国首个获得FDA紧急使用授权用于5至11岁群体的COVID-19疫苗。
来源:FDA官网
中美双报、新药注册、IND/NDA/BLA申报,尽在奥来恩!
Merck和Ridgeback的MOLNUPIRAVIR获英国MHRA批准上市
11月4日,Merck和Ridgeback Biotherapeutics联合开发的Molnupiravir (MK-4482, EIDD-2801)获英国药品和健康产品管理局(United Kingdom Medicines and Healthcare productsRegulatory Agency, MHRA)批准上市,用于治疗患有中度到重度COVID-19的成人患者——SARS-CoV-2检测阳性且至少有一种发展为重症的风险因素。Molnupiravir是首个获得批准上市用于COVID-19治疗的口服抗病毒产品。
此外,FDA将在11月30日召开顾问委员会(AMDCA)讨论该产品的紧急使用授权(EUA)申请。目前,EMA已经就Merck递交的上市申请进行滚动审评。

来源:MERCK官网
点击查看:
https://www.merck.com/news/merck-and-ridgebacks-molnupiravir-an-oral-covid-19-antiviral-medicine-receives-first-authorization-in-the-world/
CDE发布《中国新药注册临床试验现状年度报告(2020年)》
11月10日,为全面掌握中国新药注册临床试验进展,加强药品监管能力建设,CDE根据药物临床试验登记与信息公示平台登记信息,首次对中国新药注册临床试验现状进行了全面汇总分析,撰写并发布了《中国新药注册临床试验现状年度报告(2020年)》。
该报告根据2020年度登记的药物临床试验信息,从申办者类型、药物类型、试验品种、适应症、试验分期、特殊人群试验、临床试验的组长单位、启动耗时和完成情况等角度对临床试验的整体进展、主要特点、变化趋势和突出问题等进行了汇总、梳理和分析。

来源:CDE官网
点击查看:
https://www.cde.org.cn/main/news/viewInfoCommon/d670723dd2f646722097b03cf005e052
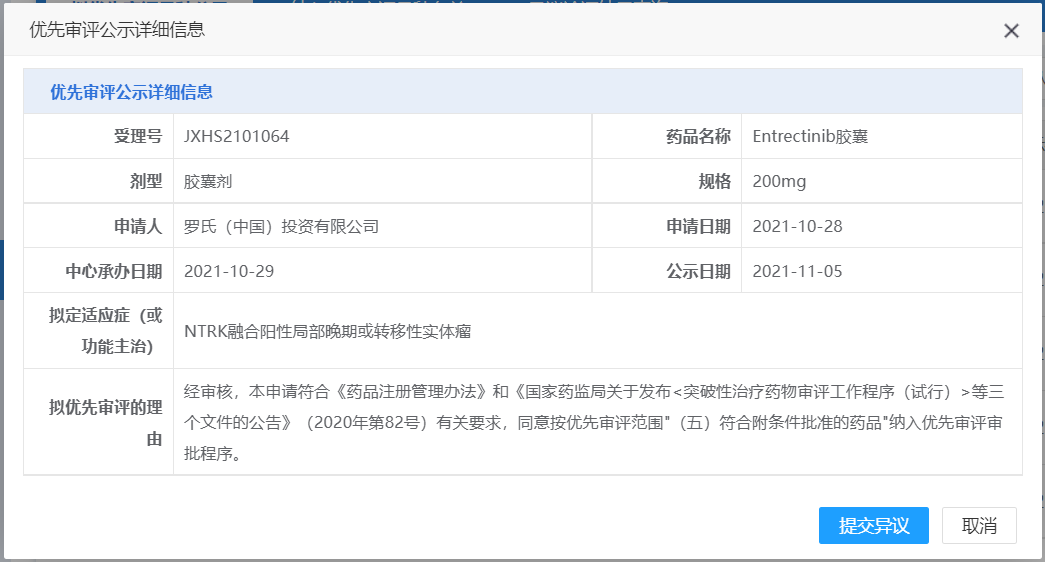
罗氏ENTRECTINIB胶囊获NMPA批准纳入拟优先审评品种
11月5日,罗氏Entrectinib胶囊获NMPA批准纳入拟优先审评品种并开始公示,拟用于治疗NTRK融合阳性局部晚期或转移性实体瘤。Entrectinib最早在日本上市,用于治疗NTRK基因融合阳性的晚期复发实体瘤成人和儿童患者,后续又分别在美国和欧盟获批上市,获批适应症除了上述适应症还有携带ROS1基因突变的转移性非小细胞肺癌。
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731
近期的重要会议(2021.11.12~2021.11.30)
1. FDA,2021.11.18,Clinical Trial Design for Non-Muscle Invasive Bladder Cancer (NMIBC)
2. FDA,2021.11.19,Best Practices for Development and Application of Disease Progression Models
3. CDE,2021.11.18,药品电子通用技术文档(eCTD)申报宣讲会(目前报名已截止,会后CDE将公布视频)


