FDA
首个治疗复发或难治性B细胞急性淋巴细胞白血病的CAR-T药物获FDA批准上市
10月1日,Kite的Tecartus®获FDA批准上市,用于治疗复发或难治性 B 细胞前体急性淋巴细胞白血病(ALL),这是该适应症首个获批的CAR-T药物。

来源:Kite官网
Camurus的CAM2029获FDA孤儿药认定
9月16日,Camurus的CAM2029(奥曲肽皮下注射液)获FDA孤儿药认定,用于治疗常染色体显性多囊肝病(PLD)。多囊肝病是一种罕见的遗传性慢性疾病,其特征是肝脏中囊肿的进行性生长,可引起严重症状并导致患者生活质量受损。

来源:Camurus官网
点击查看:
https://www.camurus.com/pressreleases/
Cantargia的NADUNOLIMAB获FDA孤儿药认定
9月22日,Cantargia AB的Nadunolimab获FDA孤儿药认定,用于治疗胰腺癌。Nadunolimab是一种白介素-1受体辅助蛋白(IL1RAP)结合抗体。

来源:Cantargia官网
Catalyst Biosciences的MarzAA获FDA孤儿药认定
9月28日,Catalyst Biosciences, Inc.的MarzAA(marzeptacog alfa (activated))获FDA孤儿药认定,用于治疗凝血因子Ⅶ缺乏症(FVIID)。该申请此前曾获得快速通道认定。

来源:Catalyst Biosciences官网
Recursion的REC-4881获FDA孤儿药认定
9月29日,Recursion的REC-4881获FDA孤儿药认定,用于治疗家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)。REC-4881是一种口服的、针对MEK1和MEK2的非ATP竞争性变构小分子抑制剂。
来源:Recursion官网
ImmixBio的IMX-110获FDA孤儿药认定
9月30日,Immix Biopharma, Inc.的IMX-110获FDA孤儿药认定,用于治疗软组织肉瘤(soft tissue sarcoma)。
来源:Immix Biopharma官网
AlloVir的POSOLEUCEL获FDA孤儿药认定
10月4日,AlloVir, Inc.的Posoleucel (Viralym-M, ALVR105) 获FDA孤儿药认定,用于治疗病毒相关的出血性膀胱炎(hemorrhagic cystitis)。

来源:AlloVir官网
PharmaTher的KETAMINE获FDA孤儿药认定
10月13日,PharmaTher Holdings Ltd.的Ketamine获FDA孤儿药认定,用于治疗复杂性局部痛综合症(complex regional pain syndrome, CRPS)。
来源:PharmaTher官网
Blade Therapeutics的Cudetaxestat获FDA孤儿药认定
10月14日,Blade Therapeutics,Inc.的Cudetaxestat获FDA孤儿药认定,用于治疗系统性硬化症。
来源:Blade Therapeutics官网
点击查看:
https://www.blademed.com/news/Oct-14-2021/
AstraZeneca的ENHERTU®获FDA突破性治疗认定
10月4日,AstraZeneca的Enhertu®(trastuzumab deruxtecan)获FDA突破性治疗认定,用于治疗不可切除或者转移性、HER2阳性的成人乳腺癌患者,这些患者之前接受过一种或更多种抗HER2方案的治疗。
来源:AstraZeneca官网
Turning Point Therapeutics的REPOTRECTINIB获FDA突破性治疗认定
10月4日,Turning Point Therapeutics,Inc.的Repotrectinib获FDA突破性治疗认定,用于治疗NTRK基因融合的晚期实体瘤病人,这些病人在接受过一次或两次酪氨酸激酶抑制剂治疗后病情继续发展并且目前无有效的可替代治疗手段。

来源:Turning Point Therapeutics官网
ISA的ISA101b获FDA快速通道认定
9月14日,ISA Pharmaceuticals的ISA101b获FDA快速通道认定,用于治疗人类乳头瘤病毒16型(HPV16)阳性的复发性和转移性口咽癌(OPC)。复发性和转移性口咽癌是一种头颈癌,目前仍有很大医疗需求未被满足。
来源:ISA Pharmaceuticals官网
BridgeBio的BBP-418获FDA快速通道认定
9月15日,BridgeBio Pharma, Inc.的BBP-418获FDA快速通道认定,用于治疗2i型肢带型肌营养不良症(Limb-girdle Muscular Dystrophy Type 2i, LGMD2i)。LGMD2i是一种单基因常染色体隐性遗传病,由FKRP基因的部分功能丧失突变引起,这些FKRP突变会损害α-DG的糖基化(α-DG是一种与稳定肌细胞相关的蛋白质)。
来源:BridgeBio Pharma官网
Sage Therapeutics的SAGE-718获FDA快速通道认定
9月15日,Sage Therapeutics, Inc.的SAGE-718获FDA快速通道认定,用于治疗亨廷顿氏病(Huntington’s disease)。亨廷顿氏病是一种影响大脑的常染色体显性遗传性疾病,会影响到一个家庭的几代人。

来源:Sage Therapeutics官网
AVEO Oncology的FICLATUZUMAB获FDA快速通道认定
9月20日,AVEO Oncology的Ficlatuzumab获FDA快速通道认定,用于治疗复发性或反复性头颈部鳞状细胞癌(HNSCC)。

来源:AVEO Oncology官网
CARISMA Therapeutics的CT-0508获FDA快速通道认定
9月22日,CARISMA Therapeutics Inc.的CT-0508获FDA快速通道认定,用于治疗实体瘤。CT-0508是一种靶向人表皮生长因子受体2(HER2)的嵌合抗原受体巨噬细胞(CAR-M)。
来源:carisma官网
NuCana的ACELARIN®获FDA快速通道认定
9月29日,NuCana plc的Acelarin®(NUC-1031)获FDA快速通道认定,用于治疗晚期胆道癌。

来源:Nucana官网
点击查看:
http://www.nucana.com/downloads/NuCana29Sept2021.pdf
DiaMedica Therapeutics的DM199获FDA快速通道认定
9月30日,DiaMedica Therapeutics Inc.的DM199获FDA快速通道认定,用于治疗急性缺血性中风(acute ischemic stroke, AIS)。

来源:DiaMedica Therapeutics官网
Recursion的REC-2282获FDA快速通道认定
10月7日,Recursion的REC-2282获FDA快速通道认定,用于治疗NF2基因突变的脑膜瘤,包括II型神经纤维瘤病相关的脑膜瘤。
来源:Recursion官网
Seagen和Genmab联合开发的TIVDAK™获FDA加速批准
9月20日,Seagen Inc.和Genmab A/S联合开发的Tivdak™(tisotumab vedotin-tftv)获FDA加速批准,用于治疗复发性或转移性宫颈癌成人患者,这些患者在化疗中或化疗后病情加重。
来源:Seagen官网
Marinus Pharmaceuticals的GANAXOLONE获FDA优先审评认定
9月20日,Marinus Pharmaceuticals, Inc.的Ganaxolone获FDA优先审评认定,用于治疗CDKL5(细胞周期蛋白依赖性激酶样5)缺乏(CDD)相关的癫痫。
来源:MARINUS官网
ViiV Healthcare的CABOTEGRAVIR获FDA优先审评认定
9月28日,ViiV Healthcare的Cabotegravir长效注射液获FDA优先审评认定,用于HIV暴露前预防。该申请此前曾获得FDA突破性治疗认定。

来源:ViiV官网
Novartis的177Lu-PSMA-617获FDA优先审评认定
9月28日,Novartis的177Lu-PSMA-617获FDA优先审评认定,用于治疗雄性激素受体通路抑制后或接受紫杉烷类化疗后转移性去势抵抗性前列腺癌(mCRPC)。

来源:NOVARTIS官网
Regeneron的LIBTAYO®补充生物制品许可申请获FDA优先审评认定
9月28日,Regeneron Pharmaceuticals,Inc.的Libtayo®(cemiplimab-rwlc)补充生物制品许可申请获FDA优先审评认定,用于治疗复发性或转移性宫颈癌成人患者,这些患者在化疗中或化疗后病情加重。

来源:REGENERON官网
NMPA
CDE正式发布《注意缺陷多动障碍(ADHD)药物临床试验技术指导原则(试行)》
9月13日,为解决注意缺陷多动障碍(ADHD)治疗药物缺乏,鼓励和推动ADHD药物研发,规范临床研究设计,提供可参照的技术规范,CDE正式发布了《注意缺陷多动障碍(ADHD)药物临床试验技术指导原则(试行)》。

来源:CDE官网
点击查看:
https://www.cde.org.cn/main/news/viewInfoCommon/2b0f84e0627bf8d61470246373c36c70
CDE正式发布《儿童用化学药品改良型新药临床试验技术指导原则(试行)》
9月13日,为解决临床儿童用药紧缺问题,鼓励药物研发者研发适宜儿童使用的剂型和规格等,CDE正式发布了《儿童用化学药品改良型新药临床试验技术指导原则(试行)》。

来源:CDE官网
点击查看:
https://www.cde.org.cn/main/news/viewInfoCommon/924cbea7b9ce702f48196eb8f80d5479
CDE发布《罕见疾病药物临床研发技术指导原则(征求意见稿)》
10月11日,为进一步提高罕见疾病临床研发效率,满足罕见疾病患者的治疗需求,结合罕见疾病特征,对罕见疾病药物研发及科学的试验设计提供建议和参考,CDE发布了《罕见疾病药物临床研发技术指导原则(征求意见稿)》。
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/news/viewInfoCommon/c8ab88e8573500b49c1d48853ab8b4fc
必贝特医药注射用BEBT-908纳入突破性治疗品种
9月29日,广州必贝特医药技术有限公司的注射用BEBT-908纳入突破性治疗品种,拟用于治疗经过至少2种系统治疗后复发或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)。
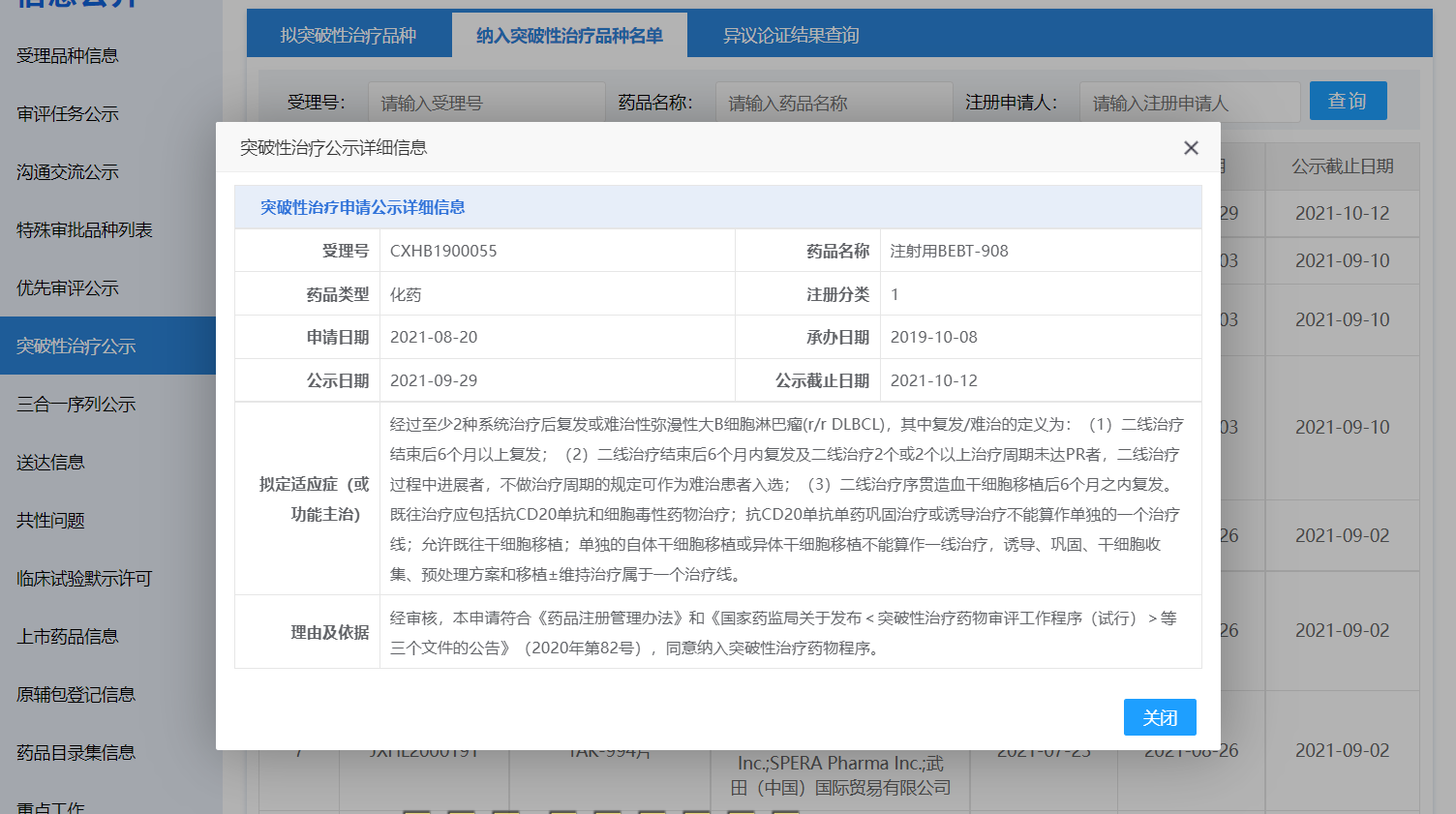
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731
两款药物纳入优先审评品种
近日,CDE信息公示,两款药物纳入优先审评品种:
1. 江苏恒瑞医药股份有限公司的马来酸吡咯替尼片(规格80mg和160mg),拟用于联合曲妥珠单抗及多西他赛治疗表皮生长因子受体2(HER2)阳性早期或局部晚期乳腺癌患者的新辅助治疗。
2. 康方药业有限公司的凯得宁单抗注射液,拟用于既往接受过含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗。
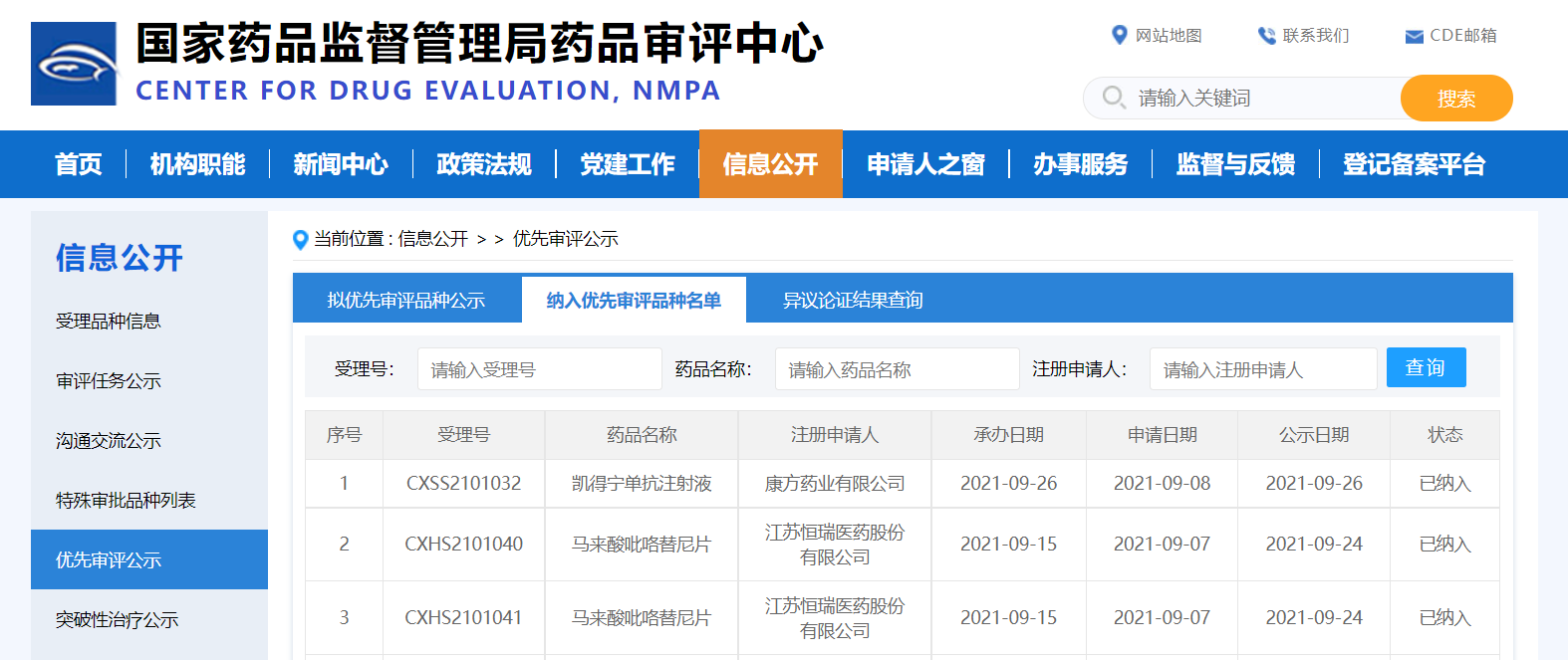
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731


