FDA
Incyte的JAKAFI®新适应症获FDA批准
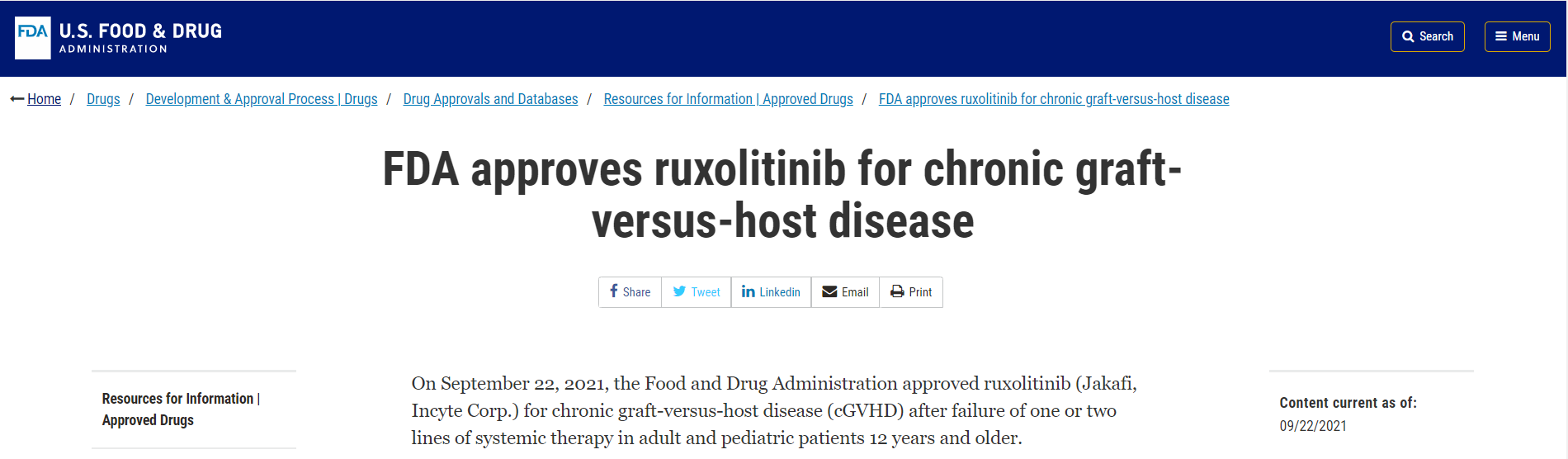
9月22日,Incyte Corp.的Jakafi®(ruxolitinib)新适应症获FDA批准,用于一线或二线系统治疗失败的慢性移植物抗宿主病人(cGVHD),适用人群为成人和12岁及以上的儿童。该申请此前曾获得孤儿药和优先审评认定。
Camurus的CAM2029获FDA孤儿药认定
9月16日,Camurus的CAM2029(奥曲肽皮下注射液)获FDA孤儿药认定,用于治疗常染色体显性多囊肝病(PLD)。多囊肝病是一种罕见的遗传性慢性疾病,其特征是肝脏中囊肿的进行性生长,可引起严重症状并导致患者生活质量受损。

https://www.camurus.com/pressreleases/
Cantargia的NADUNOLIMAB获FDA孤儿药认定
9月22日,Cantargia AB的Nadunolimab获FDA孤儿药认定,用于治疗胰腺癌。Nadunolimab是一种白介素-1受体辅助蛋白(IL1RAP)结合抗体。

中美双报、新药注册,尽在奥来恩!
ISA的ISA101b获FDA快速通道认定
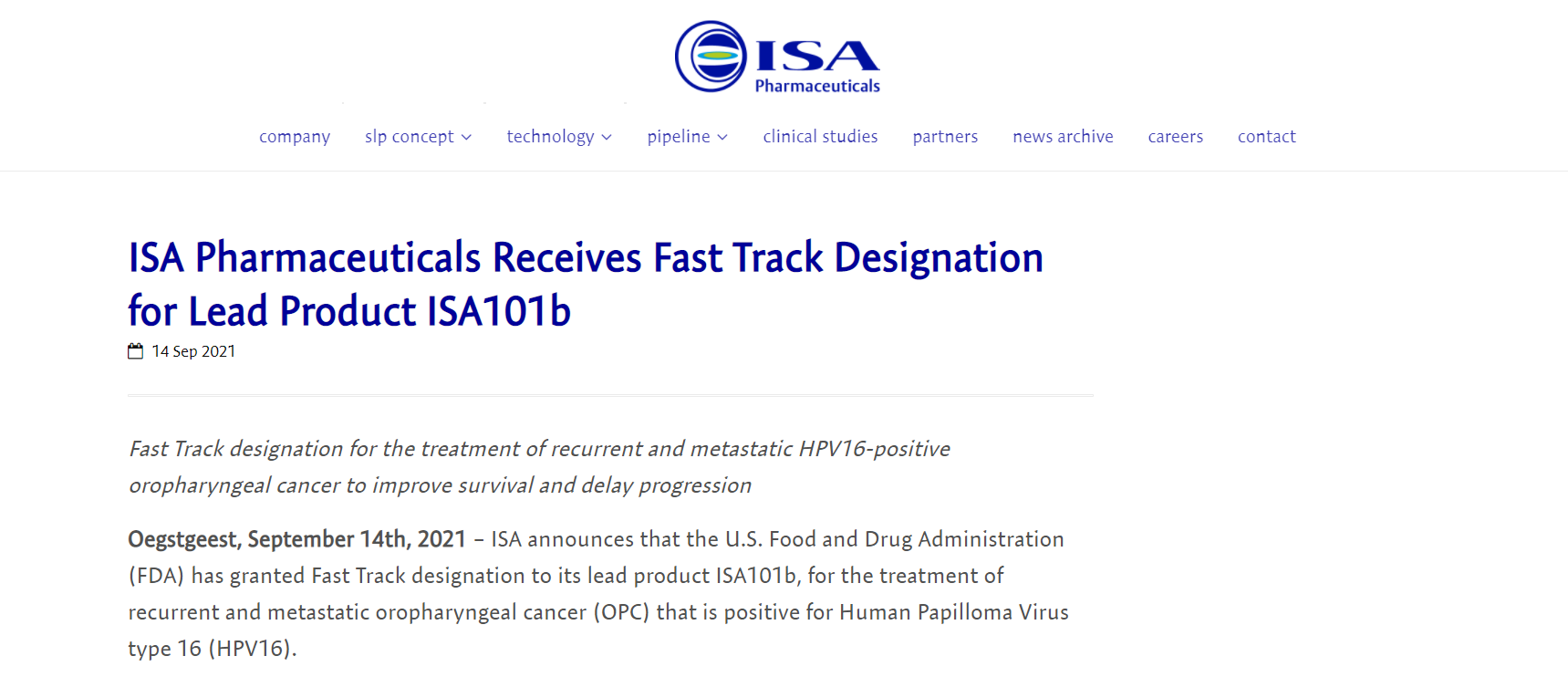
9月14日,ISA Pharmaceuticals的ISA101b获FDA快速通道认定,用于治疗人类乳头瘤病毒16型(HPV16)阳性的复发性和转移性口咽癌(OPC)。复发性和转移性口咽癌是一种头颈癌,目前仍有很大医疗需求未被满足。
BridgeBio的BBP-418获FDA快速通道认定
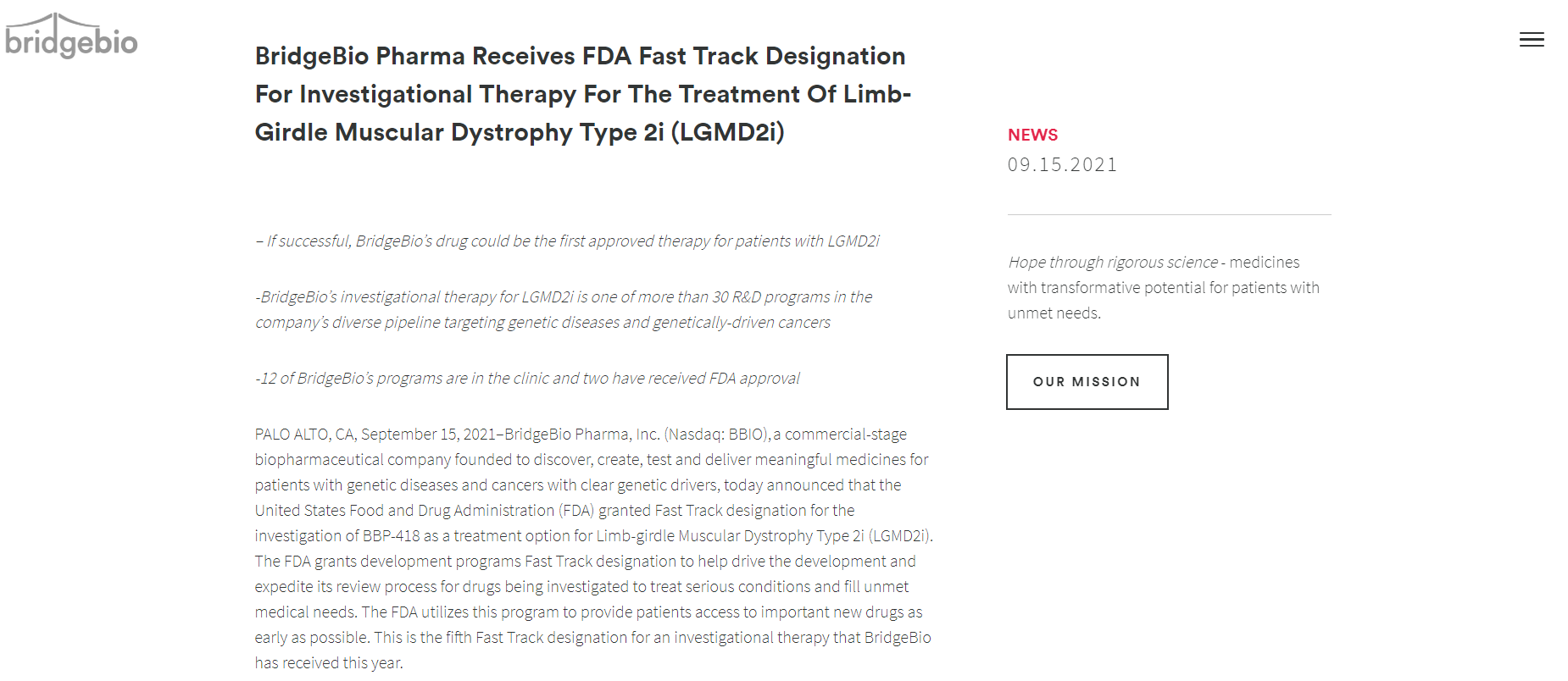
9月15日,BridgeBio Pharma, Inc.的BBP-418获FDA快速通道认定,用于治疗2i型肢带型肌营养不良症(Limb-girdle MuscularDystrophy Type 2i, LGMD2i)。LGMD2i是一种单基因常染色体隐性遗传病,由FKRP基因的部分功能丧失突变引起,这些FKRP突变会损害α-DG的糖基化——α-DG是一种与稳定肌细胞相关的蛋白质。
Sage Therapeutics的SAGE-718获FDA快速通道认定
9月15日,Sage Therapeutics, Inc.的SAGE-718获FDA快速通道认定,用于治疗亨廷顿氏病(HD)。HD是一种影响大脑的常染色体显性遗传性疾病,会影响到一个家庭的几代人。

AVEO Oncology的FICLATUZUMAB获FDA快速通道认定
9月20日,AVEO Oncology的Ficlatuzumab获FDA快速通道认定,用于治疗复发性或反复性头颈部鳞状细胞癌(R/R HNSCC)。

CARISMATherapeutics的CT-0508获FDA快速通道认定
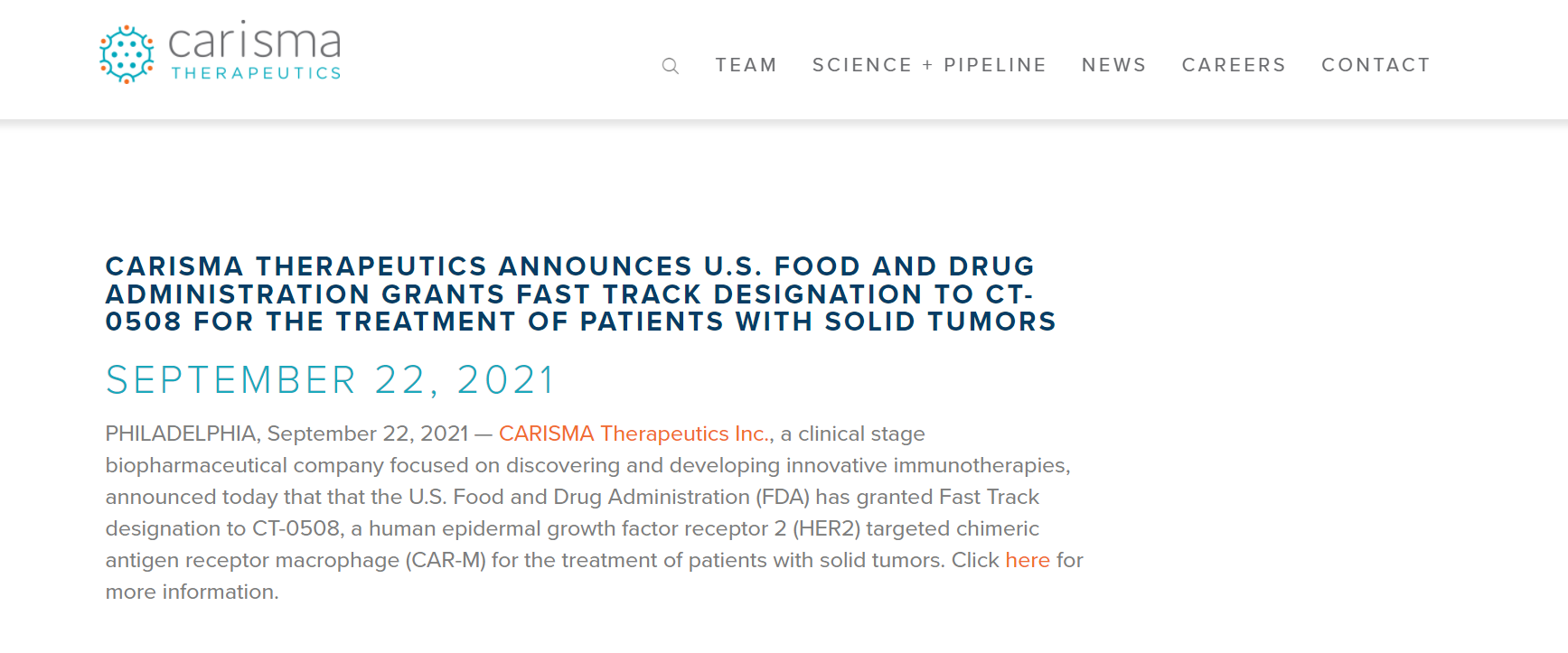
9月21日,CARISMA Therapeutics Inc.的CT-0508获FDA快速通道认定,用于治疗实体瘤。CT-0508是一种人表皮生长因子受体2(HER2)靶向的嵌合抗原受体巨噬细胞(CAR-M)。
亚盛医药的APG-115获FDA快速通道认定
9月23日,亚盛医药的MDM2-p53抑制剂APG-115(alrizomadlin)获FDA快速通道认定,用于治疗经肿瘤免疫治疗后的复发/难治性不可切除/转移性黑色素瘤。APG-115是一种口服、高选择性的小分子MDM2抑制剂,对MDM2具有高度结合亲和力,通过阻断MDM2-p53相互作用从而恢复p53肿瘤抑制活性

Marinus Pharmaceuticals的GANAXOLONE获FDA优先审评认定
9月20日,Marinus Pharmaceuticals, Inc.的Ganaxolone获FDA优先审评认定,用于治疗CDKL5(细胞周期蛋白依赖性激酶样5)缺乏(CDD)相关的癫痫。
NMPA
CDE正式发布《注意缺陷多动障碍(ADHD)药物临床试验技术指导原则(试行)》
9月13日,为解决注意缺陷多动障碍(ADHD)治疗药物缺乏,鼓励和推动ADHD药物研发,规范临床研究设计,提供可参照的技术规范,在国家药品监督管理局的部署下,CDE正式发布了《注意缺陷多动障碍(ADHD)药物临床试验技术指导原则(试行)》。

https://www.cde.org.cn/main/news/viewInfoCommon/2b0f84e0627bf8d61470246373c36c70
CDE正式发布《儿童用化学药品改良型新药临床试验技术指导原则(试行)》
9月13日,为解决临床儿童用药紧缺问题,鼓励药物研发者研发适宜儿童使用的剂型和规格等,在国家药品监督管理局的部署下,CDE正式发布了《儿童用化学药品改良型新药临床试验技术指导原则(试行)》。

https://www.cde.org.cn/main/news/viewInfoCommon/924cbea7b9ce702f48196eb8f80d5479


