FDA
Moderna完成COVID-19疫苗BLA递交
近日,Moderna完成了其COVID-19疫苗BLA所需数据的递交,并向FDA申请优先审评认定。一旦获得优先审评认定,FDA将会确保在6个月内完成上市申请的审评。
该疫苗在5月12日获得FDA快速通道认定,允许其滚动提交三期临床数据。Moderna从6月1日开始递交BLA材料。根据2020年12月18日获得的紧急使用授权(EUA),Moderna的疫苗适用于18岁及以上的人群接种。该公司于6月申请将紧急使用授权的人群扩大至12岁至17岁青少年,目前正在等待FDA的最终决定。

来源:Moderna官网
Lantern Pharma的LP-184获FDA孤儿药认定
8月30日,Lantern Pharma的候选药物LP-184获FDA孤儿药认定,用于治疗多形性胶质母细胞瘤(GBM)和其他恶性胶质瘤。
来源:Lantern官网
Polaryx Therapeutics的PLX-200获FDA孤儿药认定
9月2日,Polaryx Therapeutics, Inc.的PLX-200获FDA孤儿药认定,用于治疗克拉伯病。
来源:NEWSWIRE官网
点击查看:
中美双报、新药注册,尽在奥来恩!
TCR² Therapeutics的GAVO-CEL获FDA孤儿药认定
9月2日,TCR2 Therapeutics Inc.的 Gavo-cel获FDA孤儿药认定,用于治疗胆管癌。

来源:TCR2官网
Neuren的NNZ-2591获FDA孤儿药认定
9月3日,Neuren Pharmaceuticals的NNZ-2591获FDA孤儿药认定,用于治疗普拉德-威利综合征(Prader-Willi syndrome)。

来源:Neuren官网
Versantis的VS-01获FDA孤儿药认定
9月7日,Versantis AG的VS-01获FDA孤儿药认定,用于治疗先天性代谢障碍(IEM)中的高氨血症(HA)。

来源:Versantis AG官网
点击查看:
https://www.versantis.ch/achievements.php
Novartis的LNA043获FDA快速通道认定
9月2日,Novartis的LNA043获FDA快速通道认定,用于治疗膝关节骨关节炎。

来源:Novartis官网
HiberCell的HC-5404-FU获FDA快速通道认定
9月8日,HiberCell的HC-5404-FU获FDA快速通道认定,用于治疗实体瘤。

来源:HiberCell官网
NMPA
CDE正式发布《纳米药物质量控制研究技术指导原则(试行)》《纳米药物非临床药代动力学研究技术指导原则(试行)》《纳米药物非临床安全性评价研究技术指导原则(试行)》
8月27日,为规范和指导纳米药物研究与评价,在国家药品监督管理局的部署下,药审中心正式发布了《纳米药物质量控制研究技术指导原则(试行)》《纳米药物非临床药代动力学研究技术指导原则(试行)》《纳米药物非临床安全性评价研究技术指导原则(试行)》。

来源:CDE官网
点击查看:
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=a666d62911aad267
CDE正式发布《化学药品和治疗用生物制品说明书中儿童用药相关信息撰写的技术指导原则(试行)》
9月3日,为促进企业有序开展起草和完善药品说明书中儿童用药信息的相关工作,更好的指导临床合理用药,在国家药品监督管理局的部署下,药审中心正式发布了《化学药品和治疗用生物制品说明书中儿童用药相关信息撰写的技术指导原则(试行)》。
来源:CDE官网
点击查看:
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=33130541ea267a71
CDE网站升级,将增加eCTD专栏
9月7日,CDE宣布,为进一步提升服务能力,提高中心网站易用性、安全性,药审中心网站将于9月10日19:00—9月13日7:00进行升级部署。本次网站升级进一步扩大了申请人网上业务办理范围,增加了“行政受理服务专栏”、“eCTD专栏”、“公文在线提交”等栏目,进一步整合重构了“化学药品目录集”、“仿制药质量与疗效一致性评价”、“指导原则”、“信息公开”等栏目。

来源:CDE官网
点击查看:
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=7724166d3c264c27
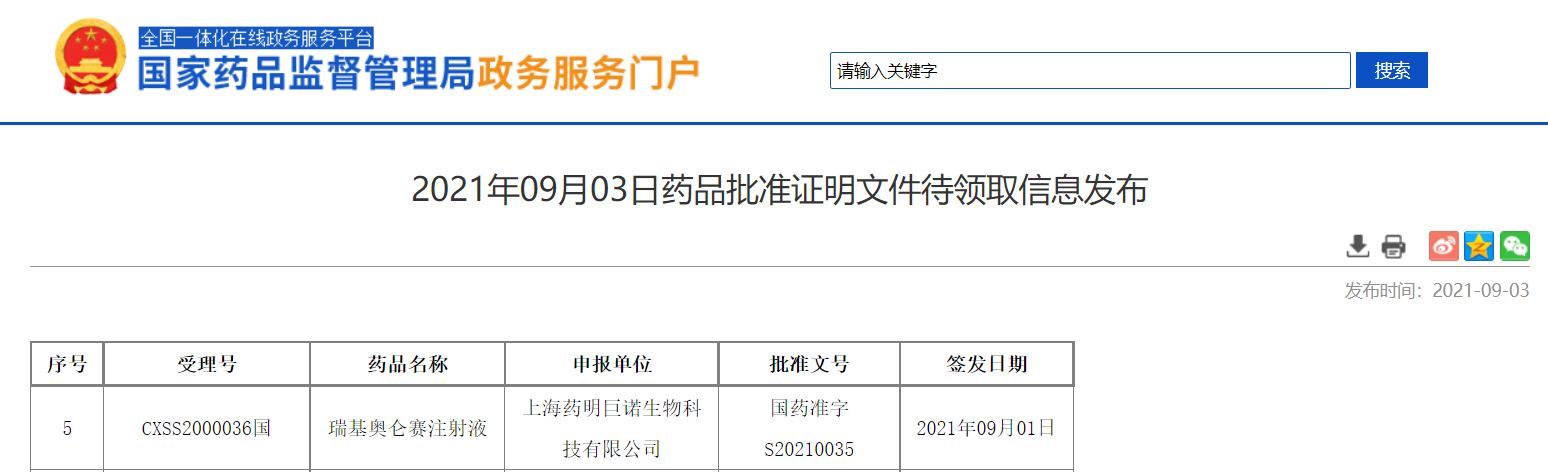
药明巨诺的瑞基奥仑赛注射液获NMPA批准上市
9月3日,NMPA公告,药明巨诺的细胞免疫治疗产品倍诺达®(瑞基奥仑赛注射液)获NMPA批准上市,用于治疗经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤(r/r LBCL)。该产品是中国首款按1类生物制品获批的CAR-T产品。
来源:NMPA官网
点击查看:
https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20210903084004127.html
四款药物纳入拟突破性治疗品种
近日,CDE信息公示,四款药物纳入拟突破性治疗品种:
1. 武田(中国)国际贸易有限公司的TAK-994片,用于治疗发作性睡病1型;
2. 江苏恒瑞医药股份有限公司的SHR3680片,用于治疗高瘤负荷的转移性激素敏感性前列腺癌患者;
3. 和记黄埔医药(上海)有限公司的HMPL-689胶囊,用于治疗既往至少接受过二线系统性治疗,且其中至少有一线治疗包含CD20单抗(CD20单抗单药治疗或联合化疗)的复发/难治FL患者(病理分级Grade 1-3a);
4. 杭州泰格医药科技股份有限公司的FPA144注射液,与mFOLFOX6 (氟尿嘧啶、亚叶酸和奥沙利铂) 联合用于一线治疗FGFR2b过表达 (免疫组织化学法检测至少10%肿瘤细胞过表达FGFR2b)、人表皮生长因子受体(HER2)阴性局部晚期或转移性胃和胃食管结合部癌(GEJ)患者。
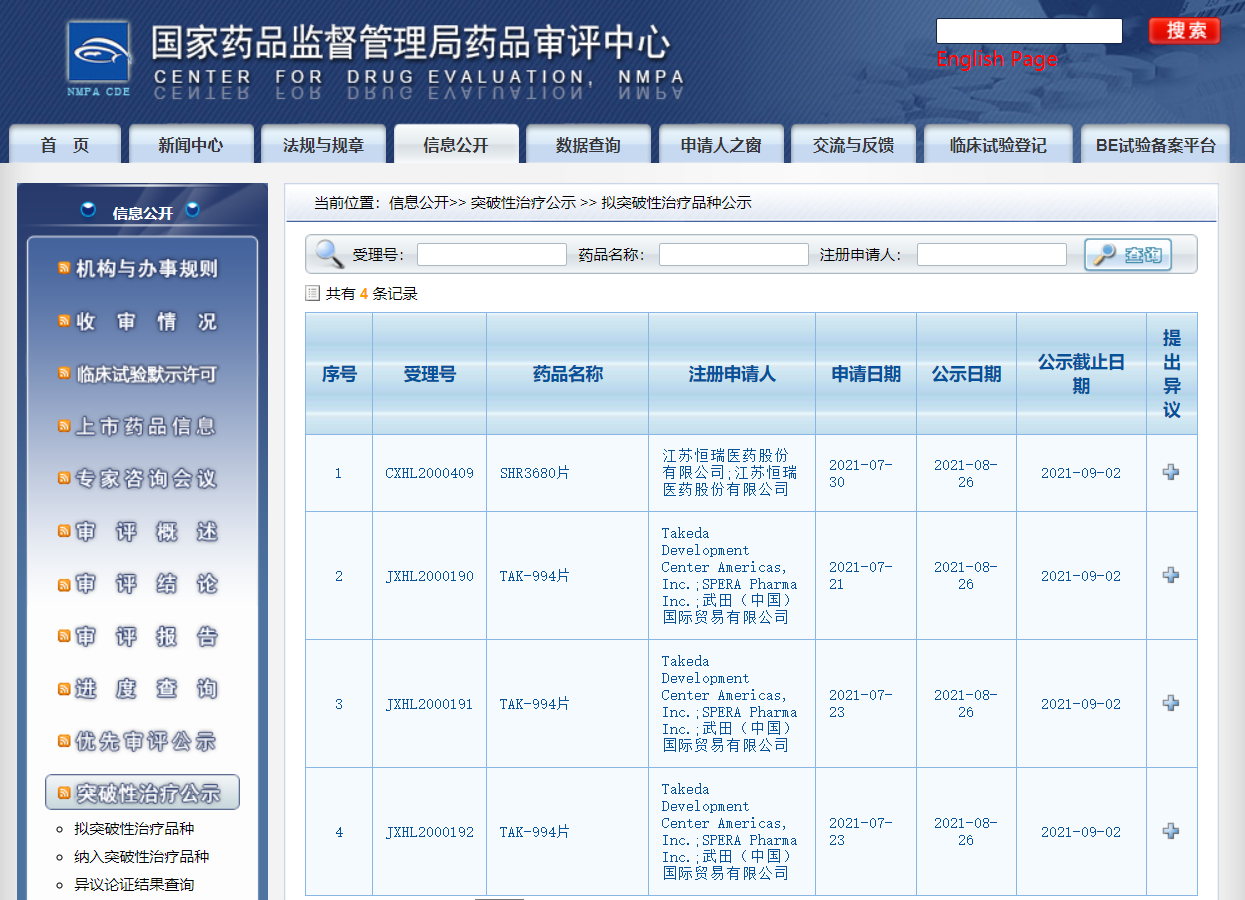
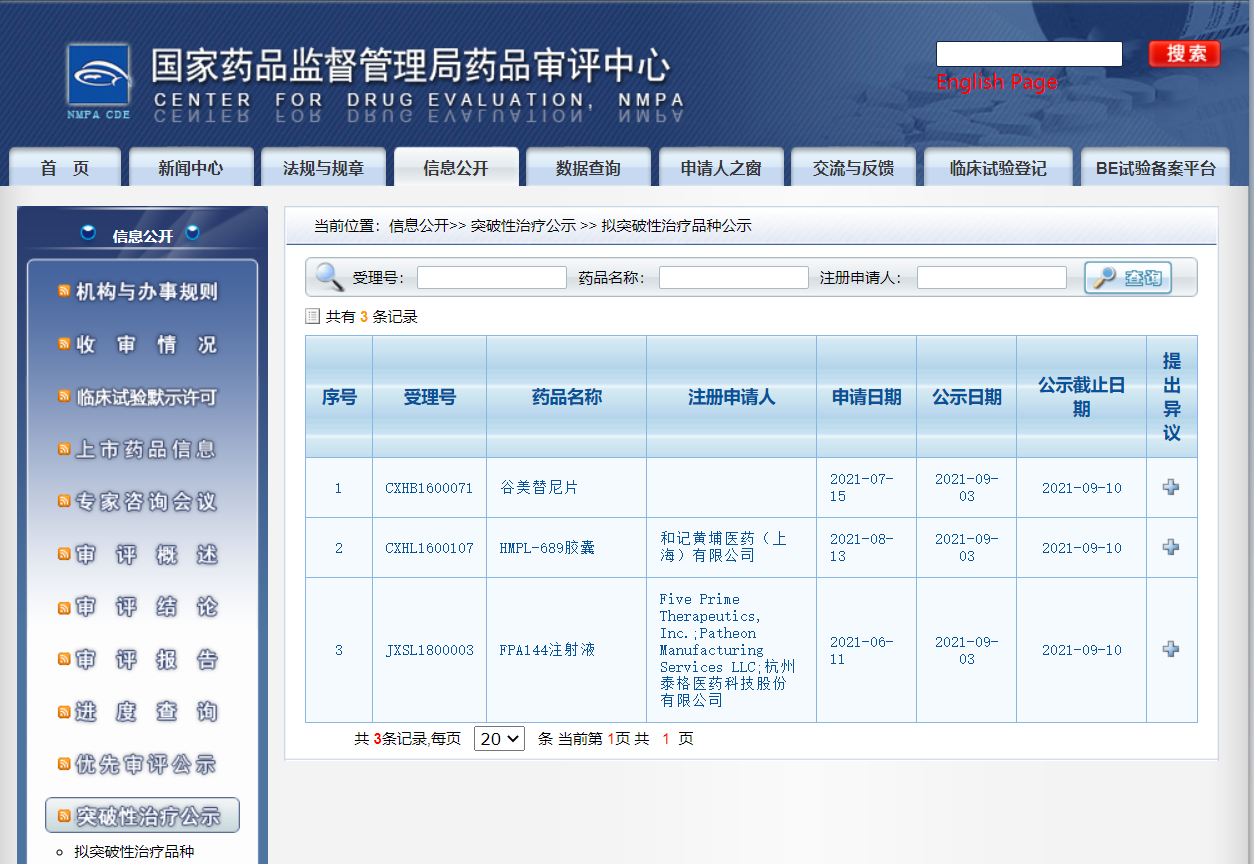
来源:CDE官网
点击查看:
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20#
五款药物纳入拟优先审评品种
近日,CDE信息公示,五款药物纳入拟优先审评品种:
1. 荣昌生物制药(烟台)股份有限公司的注射用维迪西妥单抗,用于治疗既往接受过系统化疗且HER2表达为免疫组化检查结果为2+或3+的局部晚期或转移性尿路上皮癌的患者;
2. 赛生医药(中国)有限公司的那昔妥单抗注射液,与粒细胞-巨噬细胞集落刺激因子(GM-CSF)联合给药,适用于伴有骨或骨髓病变,对既往治疗表现为部分缓解、轻微缓解或疾病稳定的1岁及以上儿童或成年复发性或难治性高危神经母细胞瘤患者;
3. 北京诺华制药有限公司的甲磺酸达拉非尼胶囊,联合曲美替尼用于治疗BRAF V600突变阳性的晚期非小细胞肺癌患者;
4. 北京诺华制药有限公司的曲美替尼片,联合甲磺酸达拉非尼用于治疗BRAF V600突变阳性的晚期非小细胞肺癌患者;
5. 礼来苏州制药有限公司的Selpercatinib胶囊,用于治疗转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者。
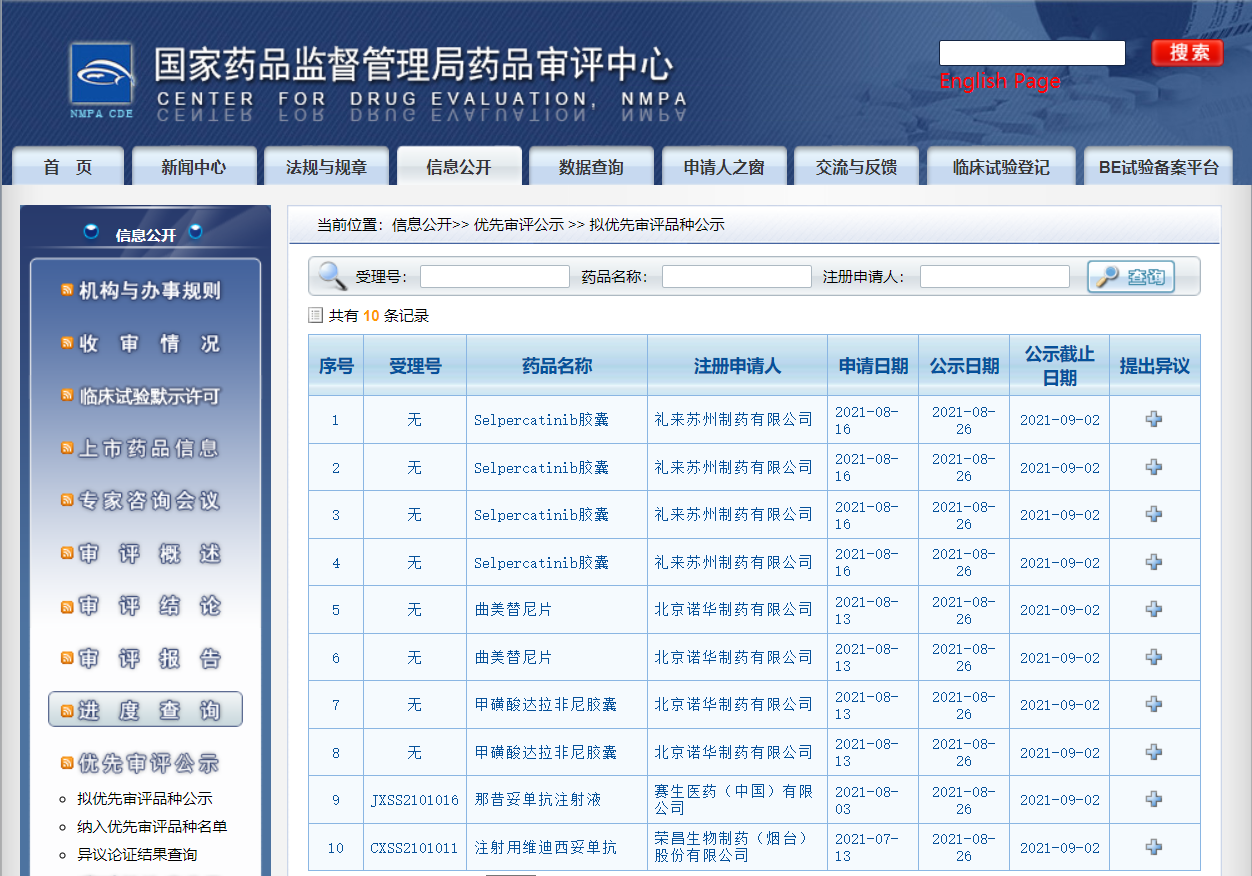
来源:CDE官网
点击查看:
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20#


