FDA
针对神经退行性疾病的基因治疗产品的上市申请或只需Ⅰ期临床试验
FDA在最近的一份指导原则草案中指出,由于罕见神经退行性疾病临床试验受试者招募比较困难,Ⅰ期临床试验可能足够为此类疾病的基因治疗产品的注册申请提供证据支持。
FDA指出,考虑基因治疗产品临床试验(人类首次)的合格性时应该把疾病的严重程度和所处的阶段作为收益-风险评估的一部分,且从可行性角度来说,临床试验应该从清楚风险并能提供知情同意的成人患者中启动。
上述指导原则还鼓励创新型临床试验设计的使用,比如适应性临床试验。同时,它还建议包含安慰剂组的临床试验在将受试者随机分组之前考虑给予所有受试者一种已经被证实的治疗。在交叉试验设计中,两个随机组交替以使所有受试者都有机会接受试验药物的治疗,这样也是可行的。

👇 点击查看:
Seagen和Genmab联合开发的TISOTUMAB VEDOTIN获FDA优先审评认定
4月9日,Seagen Inc. 和Genmab A/S联合开发的Tisotumab Vedotin获FDA优先审评认定,拟用于治疗在化疗期间或化疗后病情恶化的复发或转移性宫颈癌患者。
👇 点击查看:
Jazz Pharmaceuticals的XYWAV™补充新药申请获FDA优先审评认定
4月12日,Jazz Pharmaceuticals plc的XywavTM(钙、镁、钾、羟丁酸钠)口服溶液补充新药申请(sNDA)获FDA优先审评认定,用于治疗成人患者的特发性嗜睡症(idiopathic hypersomnia, IH)。
👇 点击查看:
vTv Therapeutics的TTP399获FDA突破性治疗认定
4月13日,vTv Therapeutics Inc.的TTP399获FDA突破性治疗认定,用作胰岛素的辅助药物治疗I型糖尿病。
👇 点击查看:
Immunomedics的TRODELVY®新适应症获FDA加速批准
4月13日,Immunomedics Inc.的Trodelvy®(sacituzumab govitecan-hziy)新适应症获FDA加速批准,用于治疗成人患者的局部晚期或转移性尿路上皮癌(mUC),这些患者之前已经接受过一种铂类化疗以及一种PD-1抑制剂或者PD-L1抑制剂治疗。

👇 点击查看:
NMPA
CDE正式发布《用于产生真实世界证据的真实世界数据指导原则(试行)》
4月15日,CDE公告,为进一步指导和规范申办者利用真实世界数据生成真实世界证据支持药物研发,药审中心发布了《用于产生真实世界证据的真实世界数据指导原则(试行)》。

👇 点击查看:
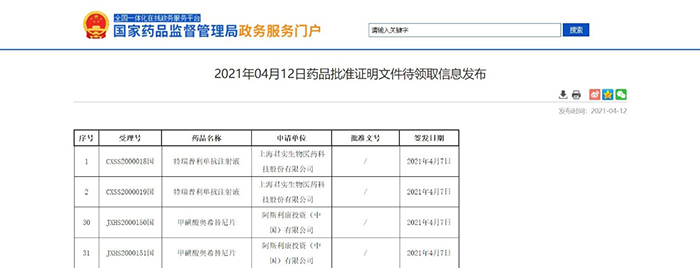
两款药物新适应症获NMPA批准
近日,NMPA信息公示,两款药物新适应症获NMPA批准:
1. 上海君实生物医药科技股份有限公司的特瑞普利单抗注射液,用于治疗铂类化疗失败(包括新辅助或辅助化疗12个月内恶化)的局部晚期或转移性尿路上皮癌患者;
2. 阿斯利康投资(中国)有限公司的甲磺酸奥希替尼片,用于治疗IB-IIIA期存在表皮生长因子受体(EGFR)外显子19缺失或外显子21(L858R)置换突变的非小细胞肺癌(NSCLC)患者。
👇 点击查看:
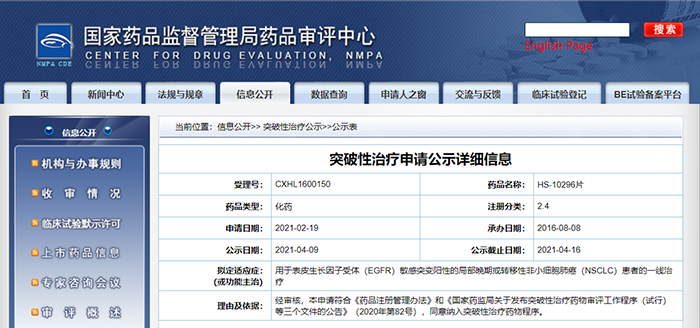
豪森药业HS-10296片纳入拟突破性治疗品种
4月9日,CDE信息公示,江苏豪森药业集团有限公司的HS-10296片纳入拟突破性治疗品种,拟用于表皮生长因子受体(EGFR)敏感突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的一线治疗。
👇 点击查看:
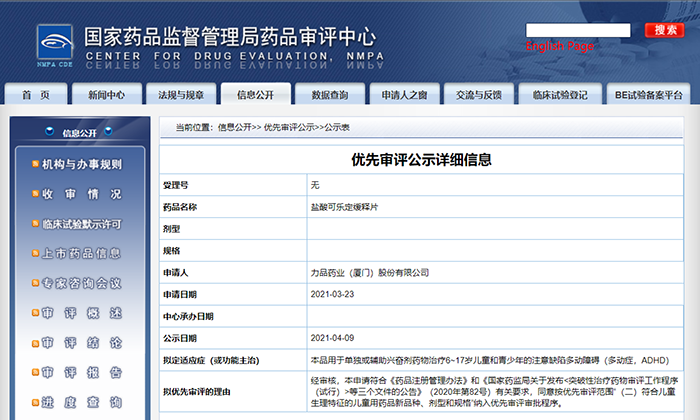
力品药业盐酸可乐定缓释片纳入拟优先审评品种
4月9日,CDE信息公示,力品药业(厦门)股份有限公司的盐酸可乐定缓释片纳入拟优先审评品种,拟用于单独或辅助兴奋剂药物治疗6~17岁儿童和青少年的注意缺陷多动障碍(多动症,ADHD)。
👇 点击查看:


