FDA
FDA基于真实世界证据批准Prograf®的新适应症
近日,FDA基于一项非干预性研究提供的真实世界数据(RWE)批准了Prograf®(tacrolimus)的新适应症:Prograf®与其他免疫抑制剂联用预防成人和儿童患者接受肺移植后出现的器官排斥反应。Prograf®最初被批准用于预防患者接受肝移植后的器官排斥反应,后来又被批准用于预防肾移植和心脏移植的器官排斥反应。在临床实践中,该药物也经常用于肺移植患者出现的排斥反应。FDA此次决策标志着免疫抑制剂首次获批用于预防成人和儿童患者肺移植出现的器官排斥反应。
来源:FDA官网
点击查看:https://www.fda.gov/drugs/drug-safety-and-availability/fda-approves-new-use-transplant-drug-based-real-world-evidence?utm_medium=email&utm_source=govdelivery
Prilenia Therapeutics的PRIDOPIDINE获FDA孤儿药认定
7月12日,Prilenia Therapeutics B.V. 的Pridopidine获FDA孤儿药认定,用于治疗肌萎缩侧索硬化(ALS)。
来源:Prilenia官网
点击查看:https://www.prilenia.com/fda-grants-orphan-drug-designation-for-pridopidine-for-the-treatment-of-als
Aldeyra Therapeutics的ADX-2191获FDA孤儿药认定
7月20日,Aldeyra Therapeutics, Inc.的ADX-2191获FDA孤儿药认定,用于治疗原发性玻璃体视网膜淋巴瘤(PVRL)。

来源:Aldeyra官网
点击查看:https://ir.aldeyra.com/news-releases/news-release-details/aldeyra-therapeutics-receives-orphan-drug-designation-us-food
VENCLEXTA®与AZACITIDINE联用获FDA突破性治疗认定
7月20日,Genentech宣布Venclexta® (venetoclax) 与Azacitidine联用获FDA突破性治疗认定,用于先前未曾接受过治疗的中危、高危和极高危骨髓增生异常综合征(MDS)成人患者。
来源:Genentech官网
点击查看:https://www.gene.com/media/press-releases/14921/2021-07-20/fda-grants-breakthrough-therapy-designat
Alkeus Pharmaceuticals的ALK-001获FDA突破性治疗认定
7月14日,Alkeus Pharmaceuticals, Inc.的ALK-001(C20-D3-vitamin A)获FDA突破性治疗认定,用于治疗斯塔加特病(Stargardt Disease)。
来源:Alkeus官网
点击查看:http://www.alkeuspharma.com/2021-07-14-press-release.html
Pfizer和BioNTech的COVID-19 mRNA疫苗获FDA优先审评认定
7月16日,Pfizer Inc.和BioNTech SE联合开发的mRNA疫苗获FDA优先审评认定,用于16岁及以上人群COVID-19的预防。
来源:BioNTech官网
点击查看:https://investors.biontech.de/news-releases/news-release-details/us-fda-grants-priority-review-biologics-license-application
COSELA™与化疗联用获FDA快速通道认定
7月19日,G1 Therapeutics, Inc.宣布Cosela™(trilaciclib)与化疗联用获FDA快速通道认定,用于治疗局部晚期或转移性三阴性乳腺癌(TNBC)。
来源:G1官网
点击查看:http://investor.g1therapeutics.com/news-releases/news-release-details/g1-therapeutics-receives-fast-track-designation-us-food-and-drug
BlueRock Therapeutics的DA01获FDA快速通道认定
7月19日,BlueRock Therapeutics LP的DA01获FDA快速通道认定,用于治疗晚期帕金森病(PD)。

来源:Bluerocktx官网
点击查看:https://bluerocktx.com/news/bluerock-therapeutics-receives-fda-fast-track-designation-for-da01-in-the-treatment-of-advanced-parkinsons-disease/
NMPA
CDE正式发布《中药、化学药品及生物制品生产工艺、质量标准通用格式和撰写指南》
近日,CDE正式发布《中药、化学药品及生物制品生产工艺、质量标准通用格式和撰写指南》。自本文件发布之日起,申请人提出的药品注册申请,如涉及生产工艺和质量标准核准的,按照新发布通用格式撰写生产工艺和质量标准;对于在审品种,涉及生产工艺和质量标准核准的,申请人与药审中心未接洽或正在接洽的,按照新发布通用格式核准,已完成接洽的,可按原有通用格式继续审评审批。

来源:CDE官网
点击查看:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=785907e103561dcf
三款药物纳入拟突破性治疗品种
近日,CDE信息公示,三款药物纳入拟突破性治疗品种:1. 西安杨森制药有限公司的JNJ-56136379片,拟用于治疗慢性乙型肝炎病毒感染;
2. 西安杨森制药有限公司的JNJ-73763989注射剂,拟用于治疗慢性乙型肝炎病毒感染;
3. 赛诺菲(中国)投资有限公司的注射用重组人凝血因子VIII Fc-血管性血友病因子-XTEN融合蛋白,拟用于治疗患有A型血友病的成人和儿童:(1)常规预防治疗,用于减少出血的发生频率(2)出血的按需治疗(3)围手术期出血的处理。

来源:CDE官网
点击查看:http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=26
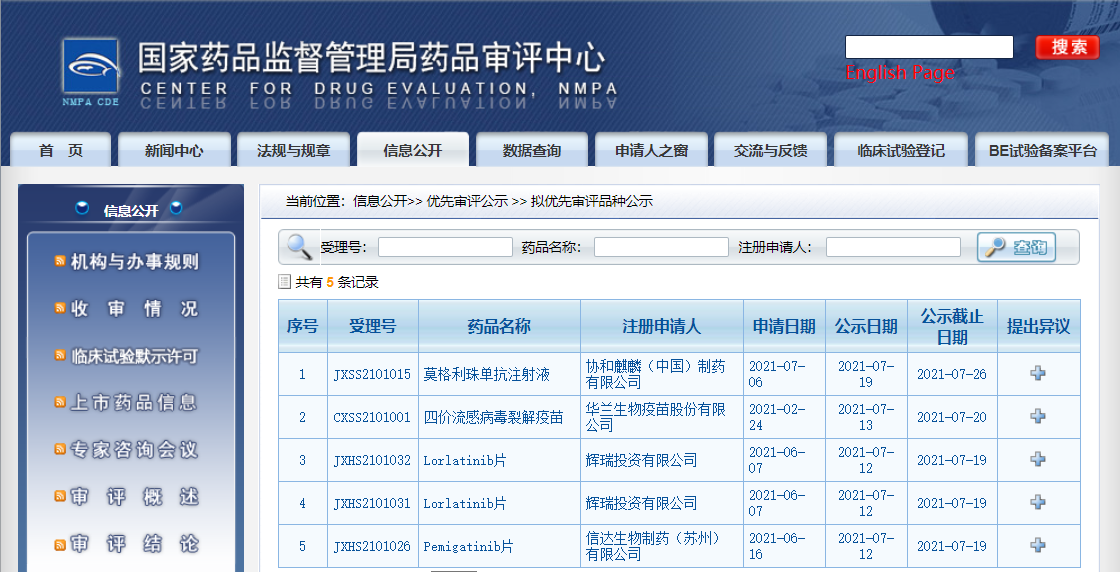
五款药物纳入拟优先审评品种
近日,CDE信息公示,五款药物纳入拟优先审评品种:1. 信达生物制药(苏州)有限公司的Pemigatinib片,拟用于治疗既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者;
2. 辉瑞投资有限公司的Lorlatinib片,拟用于治疗既往接受过一种或多种间变性淋巴瘤激酶(ALK)酪氨酸激酶抑制剂(TKI)治疗的ALK阳性局部晚期或转移性非小细胞肺癌(NSCLC)患者;
3. 华兰生物疫苗股份有限公司的四价流感病毒裂解疫苗,拟用于6个月至3岁以下人群预防相关型别的流感病毒引起的流行性感冒;
4. 协和麒麟(中国)制药有限公司的莫格利珠单抗注射液,拟用于治疗既往接受过至少一次全身性治疗的蕈样肉芽肿(MF)或 Sézary综合征(SS)成人患者;
5. 百济神州(上海)生物科技有限公司的替雷利珠单抗注射液,拟用于既往经治的局部晚期不可切除或转移性高度微卫星不稳定型(MSI-H)或错配修复缺陷型(dMMR)实体瘤。
来源:CDE官网
点击查看:http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=26#


